Plaušu vēzis ir viens no izplatītākajiem audzējiem pasaulē. Līdzīgi kā lielākajā daļā Eiropas valstu un ASV, Latvijā plaušu vēzis ir viens no biezākaiem vēža veidiem. Plaušu vēzis veido ap 10% visu Latvijā diagnosticēto vēža gadījumu gadā jeb tie ir aptuveni 1200 jauni pacienti gadā. Vīrieši ar plaušu vēzi slimo trīs reizes biežāk nekā sievietes. Pēdējos gados pieaug arī sieviešu saslimstība ar plaušu vēzi. Saslimstība lielākoties ir tieši saistīta ar smēķēšanu. Visvairāk slimo cilvēki vecuma grupā no 60 līdz 80 gadiem.
Plaušas ir mīksts, sūkļveidīgs, konusveida pāra orgāns. Plaušas nodrošina elpošanu – ogļskābās gāzes un skābekļa apmaiņu. Tā kā plaušas ir organisma iekšējā vide, kas nemitīgi saskaras ar ārējo, tai ir labi pielāgota un specializēta uzbūve ne tikai gāzu apmaiņai, bet arī aizsardzībai – elpceļos tiek aizturēti un izvadīti ārā dažādi ieelpotie infekcijas izraisītāji, putekļi un dūmi. Labo plaušu veido trīs daivas, kreiso plaušu – divas daivas. Gaiss līdz plaušām nokļūst caur deguna vai mutes dobumu, rīkles dobumu, balseni un elpvadu – traheju. Traheja sadalās divos lielajos bronhos – labajā un kreisajā. Lielie bronhi sadalās sīkākos un izveido bronhu koku. Katrs šā koka zariņš ir atbildīgs par nelielu norobežotu plaušas daļu – segmentu. Bronhu mazākie zariņi, ko sauc par bronhiolām, pāriet alveolās, kur notiek skābekļa un ogļskābā gāzes apmaiņa. Plaušās nav muskuļu, tāpēc tās nevar izplesties vai sarauties pašas, bet to struktūra ļauj sekot elpošanas kustībām. Elpošanas kustības veic starpribu muskuļi un diafragma.
"Lai atvieglotu plaušu kustības, tās aptver pleira – apvalks, kas sastāv no divām lapām – parietālās un viscerālās pleiras.
Parietālā pleira ir pievienota krūškurvja sienai. Viscerālā pleira piestiprinās pie katras plaušas ārējās virsmas. Starp abām pleiras lapām veidojas neliela telpa, ko sauc par pleiras dobumu. Pleiras dobumā ir nedaudz ūdeņaina šķidruma, ko sauc par pleiras šķidrumu. Tas novērš berzi un satur kopā pleiras virsmas ieelpas un izelpas laikā.
Dziļo elpceļu šūnu struktūra ir pietiekami specializēta un labi piemērota elpošanai. Visi elpceļi izklāti ar epitēliju, kas ir īpaši pielāgotas šūnas, lai veiktu vairākas svarīgas funkcijas:
- aizsardzību;
- gļotu sekrēciju;
- kairinošu vielu izvadīšanu;
- imūnreakcijas uzsākšanu.
Epiteliālo audu veids ir atšķirīgs dažādās elpceļu vietās. Lielāko daļu elpceļu gļotādas veido skropstiņepitēlijs. Šīs šūnas ir vertikālas, izkārtotas vienā slānī ar skropstiņām uz elpceļu pusi. Skropstiņas vienmēr kustas virzienā uz āru. Sīkāku elpceļu gļotādu veido epitēlijs bez skropstiņām.
Elpceļu epitēlijā ir arī dziedzeri – kausveida šūnas. Tās ir specializētas šūnas, kas ražo un izdala gļotas. Šo šūnu producētās gļotas nepieciešamas, lai mitrinātu epitēlija virsmu un mehāniski aizsargātu gļotādu.
Gļotas ir lipīgas, tāpēc tās piesaista ieelpotos mikroskopiskos svešķermeņus un pēc tam tos izvada ar skropstiņepitēlija palīdzību.
Plaušas ir elpošanas sistēmas pāra orgāns, kas atrodas krūškurvī un nodrošina dzīvībai nepieciešamo gāzu apmaiņu. Nodrošinot elpošanu, plaušas kalpo arī kā filtrs – tātad visas kaitīgās vielas no elpceļiem nonāk plaušās un negatīvi ietekmē kā pašas plaušas, tā arī cilvēka organisma veselības stāvokli kopumā. Nav noslēpums, ka galvenais kaitīgais faktors, kas nelabvēlīgi ietekmē plaušas, ir smēķēšana. Plaušu vēža risks pieaug ar laiku un ir atkarīgs no izsmēķēto cigarešu skaita.
Smēķēšana bojā šūnas, kas izklāj elpceļus un plaušas. Jau mirklī, kad jūs ieelpojat cigarešu dūmus (kas satur vairākas vēzi izraisošas vielas – kancerogēnus), nekavējoties sākas pārmaiņas plaušu audos. Sākumā organisms ir spējīgs tikt galā ar šūnu bojājumiem un salabot tos, taču ar katru nākamo reizi bojājums kļūst nopietnāks, izraisot pārmaiņas šūnās un veicinot to pārtapšanu par vēža šūnām. Vēzis var attīstīties gan aktīviem, gan pasīviem smēķētājiem. Svarīgi, ka, atmetot smēķēšanu pat pēc vairāku gadu smēķēšanas stāža, jūs varat būtiski samazināt plaušu vēža attīstības risku. Diemžēl izvairīšanās no smēķēšanas negarantē, ka cilvēks nesaslims, un šādos gadījumos ir grūtāk skaidri identificēt slimības iemeslu, kas varētu būt iedzimtība, azbesta vai smago metālu ietekme.
Plaušu vēža rašanās šūnu līmenī nav pilnīgi izprasta. Neseni pētījumi liecina, ka plaušu vēža attīstība nav pēkšņs bronhu epitēliju izmainošs notikums, bet ilgstošs sarežģīts process: pakāpeniska ģenētisko kļūdu rašanās, uzkrāšanās un secīgas šūnu pārmaiņas. Visa malignizācijas procesa attīstība var ilgt 10-20 gadu vai ilgāk.
Bronhu gļotādas šūnās pārmaiņas notiek galvenokārt ieelpoto kaitīgo faktoru (piemēram, cigarešu dūmi, vides piesārņojums) ilgstošas ietekmes dēļ. Pakāpeniski uzkrājoties kļūdām šūnu vairošanās regulējošos mehānismos, mainās šo šūnu izskats un dalīšanās raksturs. Epitēlijs zaudē raksturīgo izskatu, jaunu šūnu rašanās kļūst arvien straujāka, beigās vispār zūd kontrole par šūnu dalīšanos – tas ir, notiek malignizācija. Malignas (vēža) šūnas ir spējīgas neierobežoti vairoties un izplatīties organismā.
Sākotnēji plaušu vēzis attīstās lokāli un nav ieaudzis gļotādas bazālajā jeb pamata membrānā. Procesam turpinoties, vēža šūnas ieaug arī bazālajā membrānā un nonāk zemākos saistaudos un asinsvados. Audzējam ieaugot dzīlāk audos vai izplatoties pa limfvadiem vai asinsvadiem, attiecīgi pieaug slimības stadija.
Plaušu vēzi iedala: sīkšūnu plaušu vēzis (SŠPV) un nesīkšūnu plaušu vēzis (NSŠPV), atkarībā no vēža šūnu veida. Tie atšķiras gan pēc slimības gaitas, gan atbildes reakcijas uz terapiju.
Sīkšūnu plaušu vēzis (aptuveni 15% no visiem plaušu vēžiem) attīstās no bronhu gļotādas neiroendokrīnajām šūnām. SŠPV raksturīga agresīva augšana, bieži ar plaši izplatītām metastāzēm. Var ražot hormoniem līdzīgas vielas, izraisot virkni dažādu simptomu organismā. Bieži attīstās tuvāk centrāliem elpceļiem. Biežāk novērojams vīriešiem un smēķētājiem. SŠPV difūzās dabas dēļ tas parasti nav operējams, tomēr ir vairāk uzņēmīgs pret ķīmijterapiju."
"Nesīkšūnu plaušu vēzis ir biežākais plaušu vēža veids. Tas sastopams 85% visu plaušu vēža gadījumu. Nesīkšūnu plaušu vēzi iedala sīkāk:
- Adenokarcinoma ir biežākais plaušu vēža veids – aptuveni 40% visu plaušu vēža gadījumu, un tās sastopamība, salīdzinot ar citiem plaušu vēža veidiem, pieaug. Adenokarcinoma parasti rodas plaušas perifērijā no sīko bronhu gļotu dziedzeriem un ilgstoši var noritēt bez sūdzībām. Šim plaušu vēža tipam ir nosliece agrīni metastazēties reģionālajos limfmezglos un attālās vietās. Biežāk novērojama sievietēm un nesmēķētājiem.
- Plakanšūnu karcinoma. Tā veido aptuveni trešdaļu no visiem plaušu vēžiem. Tā parasti rodas centrālajos elpceļos, tāpēc, vēzim augot lielākam, tiek traucēta normāla gaisa plūsma, rodas elpas trūkums un ilgstošs klepus ar krēpām. Var būt asinsspļaušana. Biežāk novērojama vīriešiem un smēķētājiem.
- Lielšūnu karcinoma. Tā sastopama aptuveni 10% visu plaušu vēža gadījumu. Lielšūnu karcinomai raksturīga strauja augšana un plašas metastāzes. Parasti tā sākas plaušu perifērijā un var izraisīt stipras sāpes krūtīs (plaušu apvalka kairinājuma dēļ), kā arī šķidruma uzkrāšanos telpā starp plaušu un krūškurvja sienu, mokošu klepu un elpas trūkumu."
"Metastāzes
Metastāzes ir audzēja šūnu grupas, kas „aizceļojušas” no audzēja rašanās vietas uz citām ķermeņa daļām.
Metastāzes var izplatīties pa organisma dobumu virsmām, pa limfvadiem vai pa asinsvadiem (tas ir, ar asins plūsmu, ja audzēja šūnas nokļūst asinsritē).
Bronhu karcinoma bieži var izplatīties pa plaušu limfvadiem. Tā var radīt smagu elpas trūkumu jeb aizdusu. Process parasti ir vienpusējs. Bieži tiek skarti plaušu limfmezgli, kā arī videnes (telpa ap sirdi un plaušu saknēm) limfmezgli, padušu un kakla limfmezgli.
Asinis no plaušām nonāk sirdī un tālāk galvenajos asinsvados, kas apasiņo visas ķermeņa daļas. Tāpēc metastāzes plaušu vēža gadījumā var aizkļūt faktiski uz jebkuru orgānu, bet biežāk veidojas bagātīgi apasiņotos orgānos – kaulos, aknās, virsnierēs, smadzenēs.
Metastāžu biežums ir atkarīgs no ļaundabīgo šūnu veida. Piemēram, sīkšūnu plaušu vēža (SŠPV) attālas metastāzes veidojas daudz biežāk nekā nesīkšūnu plaušu vēža (NSŠPV) gadījumā.
Metastāzes kaulos ir bieža plaušu vēža komplikācija. Tās rada stipras sāpes un patoloģiskus lūzumus (proti, kauls lūst pat pie normālas ikdienas slodzes).
Jāpiebilst, ka plaušas ir ļoti bieža metastāžu vieta citiem vēžiem, piemēram, krūts, zarnu, nieru vai urīnpūšļa karcinomai.
TNM klasifikācija
Lielākā daļa audzēju, arī plaušu vēzis, tiek iedalīti, izmantojot TNM sistēmu un Starptautisko plaušu vēža klasifikācijas sistēmu (ISS). TNM sistēmas nosaukums radies no pirmajiem burtiem: Tumor – primārs audzējs, Node – metastāzes reģionālos limfmezglos, Metastases – attālas metastāzes.
Pirmais faktors T audzēju klasifikācijā apraksta primāra audzēja apjomu.
Primāra audzēja (T) izplatības pakāpes:
TX – nav iespējams veikt izmeklējumus primēra audzēja
noteikšanai.
T0 – primāru audzēju izmeklējumos nekonstatē.
Tis – primārs plaušu vēzis, kas aug virspusēji, in situ,
neinvazīvs.
T1 – primārs audzējs līdz 3 cm diametrā, neieaug galvenā
bronhā. Izdala apakšgrupas pēc izmēra T1mi, T1a, T1b, T1c.
T2 – primārs audzējs 3–5 cm diametrā VAI ieaug galvenā
bronhā zem bronhu sadalīšanās vietas, VAI cauraug pleiru,
VAI ir attīstījies plaušas saplakums vai obstruktīva pneimonija
dēļ audzēja. Apakšgrupas pēc izmēra T2a un T2b.
T3 – primārs audzējs 5–7 cm diametrā VAI ieaug perietālā
pleirā VAI sirds somiņā, VAI krūškurvja sienā, VAI diafragmālā nervā, VAI ir audzēja izsējas mezgliņi vienas plaušu daivas ietvaros.
T4 – primārs audzējs ir > 7 cm diametrā VAI jebkura izmēra
UN ieaug diafragmā VAI videnē, VAI sirdī, VAI lielajos
asinsvados, VAI trahejā, VAI barības vadā, VAI mugurkaula
skriemelī, VAI galveno bronhu sadalīšanās vietā, VAI ir
audzēja izsējas mezgliņi tās pašas plaušas citā daivā.
Limfmezglu iesaistīšanās (N) pakāpes:
Nx – nav iespējams precīzi veikt izmeklējumus reģionālo
limfmezglu iesaistes noteikšanai.
N0 – izmeklējumos audzēja izplatību reģionālos limfmezglos
nekonstatē.
N1 – audzēja skarti tās pašas puses peribronhiālie, plaušu
vārtu, plaušu iekšējie limfmezgli.
N2 – audzēja skarti tās pašas puses videnes un/vai galveno
bronhu sadalīšanās vietas (subkarinālie) limfmezgli.
N3 – audzēja skarti otrās puses plaušu reģionālie limfmezgli
vai tās pašas puses supraklavikulārie limfmezgli.
"Attālo metastāžu (M) izplatības pakāpes:
Mx – nav iespējams veikt izmeklējumus attālo metastāžu
noteikšanai.
M0 – izmeklējumos nav attālo metastāžu.
M1a – metastāzes pretējās puses plaušā, pleirā vai sirds
somiņā, ļaundabīgā šķidruma krāšanās starp pleiras vai sirds
somiņas lapiņām.
M1b – viena metastāze orgānā ārpus plaušām vai attālos, ne
reģionālos limfmezglos.
M1c – vairākas metastāzes vienā vai vairākos attālos
orgānos.
Iedalījums pēc stadijas
Līdz ar plaušu vēža diagnozi ir jānosaka arī slimības izplatība vai stadija. Tās galvenais mērķis ir apzināt iespējas ķirurģiskai operācijai kā labākajai plaušu vēža ārstēšanas iespējai. Tāpat no slimības stadijas būs atkarīgs, kādi līdzekļi būs visefektīvākie lokāli progresējošas slimības gadījumā.
Šī tabula norāda TNM iedalījumu, kas specifisks tieši plaušu vēzim:
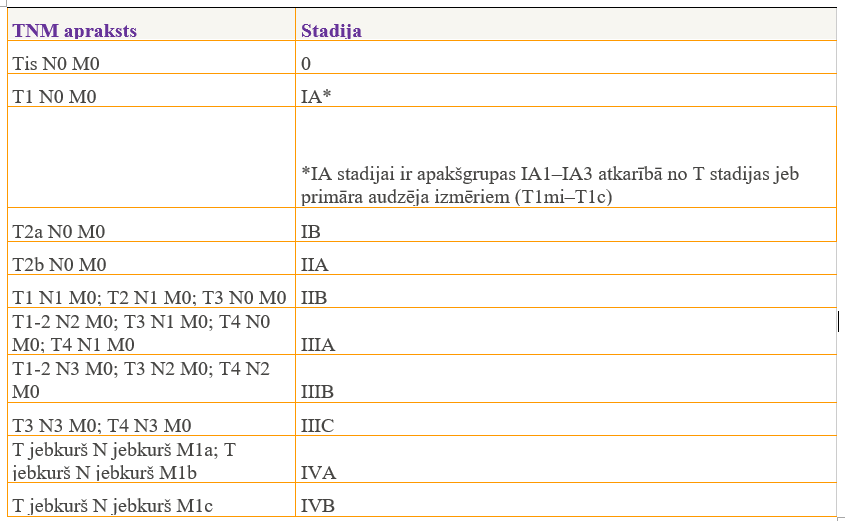
Plaušu vēža savlaicīgu diagnostiku apgrūtina fakts, ka nav ne specifisku sūdzību, ne pazīmju, kamēr audzējs nav sasniedzis pietiekoši lielu izmēru vai kamēr vēža šūnas nav izplatījušas uz limfmezgliem vai citiem orgāniem. Tāpēc diagnozes noteikšanai ir svarīgi novērtēt visu pieejamo informāciju – slimības vēsturi, smēķēšanas vai citu kaitīgo faktoru iedarbību, simptomus un izmeklēšanas datus
Lai noskaidrotu simptomu iemeslus, jānovērtē:
- medicīniskā anamnēze jeb vēsture – kādas slimības ir pārciestas un/vai turpinās joprojām (piemēram hroniska obstruktīva plaušu slimība un plaušu fibroze);
- smēķēšana – cik sen smēķē, cik daudz cigarešu dienā u. tml.;
- nelabvēlīgi apkārtējās vides (piemēram, lauksaimniecības piesārņojums) apstākļi un profesionāli kaitīgas vielas (saskarsme ar azbestu, diegvielas tvaikiem/sadegšanas produktiem, ogļu putekļiem);
- nelabvēlīga iedzimtība (onkoloģiskas slimības ģimenē).
Nevar nosaukt kādu vienu īpašu pazīmju vai simptomu grupu, kas liecinātu par plaušu vēzi.
Tomēr biežāk ziņotos plaušu vēža simptomus nosacīti var iedalīt četrās plašās kategorijās:
- audzēja lokālas augšanas un izplatīšanās izraisītie traucējumi;
- attālas metastāzes - ja plaušu veža šūnas izplatās ārpus plaušām, citos orgānos;
- nespecifiski, vispārīgi simptomi;
- paraneoplastiskie sindromi.
Simptomi, ko var radīt audzējs plaušās.
- No jauna parādījies nepārejošs klepus – sauss vai produktīvs.
- Klepus ar asins piejaukumu. Audzēja masa var būt bagāti apasiņota un pie nelielas mehāniskas iedarbības var asiņot.
- Sēkšana un elpas trūkums, ja audzējs slēdz elpceļus.
- Paaugstināta ķermeņa temperatūra, ja plaušu audzējs nosprosto plaušas daļu un attīstās infekcija – pneimonija.
- Ar laiku pieaugošas sāpes krūškurvī vai plecos.
Ja plaušu vēzis izplatās limfmezglos, var parādīties kāda no šīm pazīmēm:
- Palielināti, taustāmi limfmezgli virs/zem atslēgas kaula.
- Balss piesmakums vai apgrūtināta rīšana, ja limfmezgli spiež uz attiecīgām struktūrām.
- Sāpes krūškurvī, videnē.
- Augšējās dobās vēnas saspiedums ar sejas un kakla pietvīkumu, apgrūtinātu elpošanu dēļ asins atteces traucējumiem uz sirds labo daļu."
Ja plaušu vēža šūnas izplatās ārpus plaušām, citos orgānos, tad var tikt novēroti šādi simptomi:
- Šķidruma uzkrāšanās starp pleiras lapiņām, plaušas saspiešana. Pakāpeniski var pieaugt elpas trūkums.
- Ja vēža šūnas izplatās uz galvas smadzenēm vai smadzeņu apvalkiem, var parādīties galvassāpes, gaitas nestabilitāte, ķermeņa vienas puses vai ekstremitātes vājums, runas traucējumi, simptomi līdzīgi kā pie insulta.
- Vēža šūnām izplatoties kaulos, var parādīties kaulu sāpes. Audzēja izplatība kaulos var izraisīt kaulu trauslumu un, dažkārt, lūzumu. Rezultātā var tikt saspiestas nervu saknītes, var parādīties sāpīgums vai tirpšana vietā, ko attiecīgais nervs inervē.
Gan SŠPV, gan NSŠPV gadījumā var būt nespecifiskas, sistēmiskas pazīmes un simptomi (tā saucamā karcinomatozā intoksikācija):
- ēstgribas zudums,
- ķermeņa masas zudums,
- nespēks.
Jāatzīmē, ka pazeminātu ēstgribu bieži nenovērtē pietiekami nopietni (pat 30% gadījumu) un pamana tikai pie izteikta ķermeņa masas zuduma. Vispārējie simptomi ļoti ietekmē pacienta pašsajūtu un dzīves kvalitāti. Jebkuru simptomu gadījumā, kas parādījušies un nepāriet 2 nedēļu laikā, ir jāvēršas pie ārsta, lai veiktu papildus izmeklējumus.
Plaušu vēža šūnas dažkārt var izdalīt vielas, kas ir līdzīgas hormoniem vai veicināt antivielu sintēzi organismā. Simptomu kopumu, ko rada šo vielu sintēze, sauc par paraneoplastiskiem sindromiem:
- Ja audzējs izdala hormonu, kas ir līdzīgs hipofīzes izdalītajam hormonam, var attīstīties Kušinga sindroms – svara pieaugums, arteriālā hipertensija, paaugstināts
glikozes līmenis asinis, elektrolītu disbalanss, mēnessveida seja.
- Neiroloģiski sindromi – dažādu neiroloģisku simptomu kompleksi, kas saistīti ar sīkšūnu plaušu vēža izraisītu antivielu sintēzi pret noteiktām nervu sistēmas struktūrām.
Var izpausties ar jutības izmaiņām uz ādas, redzes traucējumiem, smadzenīšu funkcijas traucējumiem ar gaitas traucējumiem.
- Asins sastāva izmaiņas – paaugstināts leikocītu skaits, pazemināts hemoglobīna līmenis kā hroniska iekaisuma sekas, migrējošs virspusējo vēnu iekaisums ar
trombozēm.
Plaušu vēža gadījumā bieži vien var novērot audzēja metastazēšanos kaulaudos. Kaulu sāpes pacientiem ar vēzi parasti izraisa vēža šūnas, kas iekļuvušas kaulos, – tās sauc par kaulu metastāzēm. Kaulu sāpes bieži ir pirmais kaulu metastāžu simptoms, kāpēc tiek veiktas pārbaudes, kas apstiprina šo diagnozi. Kaulu bojājumu ārstēšana ir vērsta uz sāpju mazināšanu, lūzumu riska mazināšanu, lūzumu ārstēšanu un papildu kaulu komplikāciju novēršanu vai aizkavēšanu.
Kas izraisa kaulu sāpes?
Bieži sastopams kaulu sāpju cēlonis ir metastātisks vēzis. Vēža izplatīšanos no tā sākotnējās vietas uz citu vietu ķermenī sauc par metastāzēm. Kaulu metastāzes nav jauns vai cits vēzis – tas sastāv no vēža šūnām no sākotnējā vēža, piemēram, krūts, priekšdziedzera, plaušu, nieru vai vairogdziedzera vēža šūnas, kas izplatījušās kaulos.
Vēža šūnas var izplatīties jeb metastazēties visā organismā un limfātiskajā sistēmā. Kauli ir vieta ķermenī, kur vēzis metastazējas visbiežāk. Kaulos metastāzes parasti nokļūst ar asinsrites palīdzību. Vēža šūnas atdalās no sākotnējās vietas organismā un ceļo pa asinsvadiem, līdz nostiprinās pie asinsvada sienas mazā kapilāru tīklā kaulaudos. Vēzis var nonākt kaulos arī ar tiešu ieaugšanu no blakus esoša audzēja mezgla, lai gan tas notiek retāk nekā izplatīšanās ar asinsriti.
Sāpes kaulu vēža gadījumā rodas tāpēc, ka vēzis izjauc normālo šūnu darbības līdzsvaru kaulos, izraisot kaulaudu struktūras izmaiņas. Vesels kauls tiek nepārtraukti remodelēts jeb notiek kaulaudu sabrukšana un atjaunošanās. Vēža šūnas, kas izplatījušās kaulos, izjauc šo līdzsvaru starp osteoklastu (šūnu, kas sadala kaulus) un osteoblastu (šūnu, kas veido jaunu kaulu) darbību, izraisot pavājinātu vai pastiprinātu kaulu veidošanos. Šie traucējumi var tieši kairināt nervgaļus periostā (bieza membrāna, kas klāj kaulu, saukta arī par kaula plēvi), vai arī izraisīt kaulu trauslumu un lūzumu. Rezultātā var tikt saspiestas blakus esošas nervu
saknītes un var parādīties sāpīgums vai tirpšana vietā, ko attiecīgais nervs inervē.
Kā diagnosticē kaulu metastāzes?
Kaulu metastāzes parasti tiek diagnosticētas, meklējot sāpju iemeslu. Tiek veikti rentgenuzņēmumu/kompjutertomogrāfijas izmeklējumi vai sarežģītāka procedūra, ko sauc par kaulu scintigrāfiju, lai noskaidrotu, vai sāpes izraisa ar vēzi saistīts kaulu bojājums. Kaulu scintigrāfijas laikā vēnā tiek ievadītas vāji radioaktīvas daļiņas. Tās cirkulē asinīs un nokļūst kaulos. Liela šo radioaktīvo daļiņu koncentrācija kādā skeleta rajonā kaulu scintigrāfijas attēlā var liecināt par vēža šūnu izraisītu osteoblastu aktivāciju.
Kaulu sāpes var būt grūti atšķiramas no parastām muguras sāpēm vai artrīta. Parasti kaulu metastāžu izraisītas sāpes ir diezgan pastāvīgas, arī naktī. Tās var pastiprināties dažādās pozās, piemēram, stāvot (ja vēža šūnas ir svaru nesošajā kaulā). Ja sāpes ilgst nedēļu vai divas un šķiet, ka nemazinās un neatgādina citas pārciestas sāpes, noteikti jākonsultējas ar ārstu.
Kaulu metastāzes parasti ir skeleta centrālajā daļā, lai gan tās var būt jebkurā vietā kaulu sistēmā. Bieži kaulu metastāzes atrod mugurkaulā, iegurnī, augšstilbā, ribās, augšdelmā un galvaskausā; šajās vietās atklāj vairāk nekā 90% visu kaulu metastāžu.
Kā ārstē kaulu sāpes?
Kaulu metastāžu izraisītu kaulu sāpju ārstēšanas mērķis ir mazināt sāpes, ārstēt lūzumus, mazināt lūzumu risku un novērst vai aizkavēt citu komplikāciju rašanos. Kaulu metastāžu ārstēšanas paņēmieni ir pretsāpju zāles, antirezobtīvie medikamenti, staru terapija un/vai ķirurģiska ārstēšana.
Pretsāpju medikamenti
Vēža izraisītas kaulu sāpes var ārstēt ar dažādām pretsāpju zālēm. Lai gan 90% vēža slimnieku sāpes izdodas mazināt, nekontrolējamas, ar vēzi saistītas sāpes joprojām ir problēma, īpaši pacientiem, kas nav paliatīvas aprūpes specialista uzraudzībā.
Pasaules Veselības organizācijas (PVO) vēža sāpju mazināšanas ieteikumi norāda, ka pacientu sāpju stiprums, kas tiek vērtēts pēc 1-10 punktu skalas, nosaka, kādu pretsāpju zāļu veidu izvēlēties.
- Vieglas vai vidēji stipras sāpes (1-3 punkti): neopioīdi ir pirmās izvēles ārstēšanas līdzekļi vieglu vai vidēji stipru sāpju gadījumā. Pie šīs zāļu grupas pieder, piemēram, paracetamols, un nesteroīdie pretiekaisuma līdzekļi (NPL), piemēram, ibuprofēns.
- Vidēji stipras vai stipras sāpes (4-6 punkti): pacientiem ar vidēji stiprām vai stiprām sāpēm, kuriem pirmā līmeņa ārstēšana nav palīdzējusi, jāsaņem pretsāpju līdzekļi, kas pieder opioīdu klasei, t. i., narkotiskie analgētiskie līdzekļi. Šīs klases medikamentus var iegādāties tikai ar ārsta recepti. Var pievienot paracetamolu vai NPL.
- Stipras sāpes (7-10 punkti): pacientiem ar stiprām sāpēm, kā arī pacientiem, kam sāpes nav mazinājusi iepriekšējā ārstēšana, jānozīmē spēcīgāks opioīdu līdzeklis (tā iegādei arī ir nepieciešama recepte). Dažos gadījumos, iespējams, jāpievieno neopioīdu klases medikamenti, piemēram, NPL, paracetamols un citi pretsāpju terapijas pastiprinātājlīdzekļi.
Pretsāpju zālēm var būt blakusparādības – apjukums, halucinācijas, miegainība, aizcietējums, reibonis, slikta dūša un vemšana. Atvieglojums no pretsāpju zālēm ir īslaicīgs, un sāpes drīz var atsākties, tāpēc medikamentus vislabāk lietot tūlīt pēc sāpju sākšanās vai arī regulāri."
"Antirezobtīvie medikamenti
Medikamentu grupa bisfosfonāti var efektīvi mazināt kaulaudu zudumu, kas rodas no metastātiskiem bojājumiem, mazināt lūzumu risku un sāpes. Bisfosfonāti darbojas, nomācot kaulu rezorbciju jeb sabrukšanu. Kaulaudus nepārtraukti ietekmē divu veidu šūnas: osteoklasti, kas noārda vecās kaulaudu šūnas, un osteoblasti, kas atjauno kaulu struktūru. Savukārt vēža šūnas izdala dažādas vielas, kas stimulē osteoklastu aktivitāti. Lai gan precīzs bisfosfonātu darbības mehānisms nav skaidrs, uzskata, ka tie kavē un iznīcina noārdošās šūnas osteoklastus, tādējādi mazinot kaulaudu sairšanu. Vairāk nekā 30 klīnisko pētījumu dati liecina, ka pacientiem ar kaulu metastāzēm, kuri tika ārstēti ar bisfosfonātiem, pagāja ilgāks laiks līdz kaulu lūzumiem, bija mazāka nepieciešamība pēc staru terapijas, mazinājās hiperkalciēmija (paaugstināts kalcija līmenis asinīs) un mazinājās nepieciešamība pēc ortopēdiskas ķirurģiskas operācijas.
Klīniskajos pētījumos pierādīts, ka bisfosfonāti novērš vai aizkavē kaulu sabrukšanu un ar to saistītās sāpes pacientiem, kuriem bija kaulu metastāzes no:
- krūts vēža;
- priekšdziedzera vēža;
- plaušu vēža;
- multiplās mielomas;
- nieru šūnu karcinomas.
Pašreiz ir pieejams arī citas klases osteoklastus nomācošais medikaments - Denosumabs. Jāatceras, ka kaulaudus noārdošas šūnas (osteoklasti) spēlē arī svarīgu lomu kaula sadzīšanas procesā. Tāpēc invazīvas stomatoloģiskas manipulācijas (piem., zoba ekstrakcija vai implanta ielikšana) var novest pie nedzīstošām brūcēm žokļu kaulos. Pirms antirezorbtīvo medikamentu lietošanas uzsākšanas onkologi tāpēc rekomendē pacientiem veikt stomatoloģisko pārbaudi un visu problemātisku zobu sanāciju.
Staru terapija
Staru terapija efektīvi mazina kaulu sāpes un vēža izplatīšanos kaulos. To izmanto gadījumos, kad nav tūlītēja lūzuma riska. Staru terapija ir īpaši efektīva, kad metastātiskie bojājumi ir tikai kādā vienā apvidū.
Staru terapijas pamatā ir jonizējošais starojums, ko ģenerē speciāla iekārta – lineārais paātrinātājs. Staru kūlītis tiek
ieprogrammēts trāpīt tieši ļaundabīgā audzēja šūnu sakopojumam, saudzējot blakus esošus veselus audus. Staru terapijas kurss ilgst dienas līdz nedēļas katru darba dienu. Katra staru terapijas seansa laikā tiek pievadīta neliela
starojuma deva – frakcija. Ar katru nākamo frakciju audzēja šūnās uzkrājas jonizējošā starojuma ietekme, kas izraisa vēža šūnu DNS dubultspirāles pārrāvumus un bojāeju.
Staru terapiju pielieto gan audzējam plaušās, gan audzēja skartiem limfmezgliem, gan plaušu vēža metastāzēm citos orgānos - arī kaulos.
Ķirurģiska ārstēšana
Ķirurģiska operācija ir nepieciešama tūlītēja lūzuma riska gadījumā vai tādēļ, lai stabilizētu novājināto kaulu. Lai stiprinātu metastāzes bojāto kaulu vai izveidotu tā struktūru, ķirurģiski kaulā var ievietot metāla stieņus, plāksnītes, skrūves u. c."
RENTGENOGRĀFIJA (RTG)
Vienkāršs un ātrs radioloģijas izmeklējums, bet ar šī izmeklējuma palīdzību var noteikt veidojumus, kas ir lielāki par 1 cm šķērsizmērā. Ja RTG izmeklējumā izmaiņas neatrod, bet pastāv aizdomas par plaušu vēzi, ir jāveic papildu izmeklējumi.
KOMPJŪTERTOMOGRĀFIJA (KT)
Tā ir attēldiagnostikas metode, kas saliek kopā vairākus rentgenuzņēmumus dažādās plaknēs un rezultātā tiek iegūts samērā precīzs, vairākās plaknēs apskatāms, iekšējo orgānu attēls. Ar šo metodi var noteikt izmaiņas jebkuros orgānos un dobumos. Izmeklējums ilgst 10–30 minūtes, tā laikā visbiežāk vēnā ievada speciālu jodu saturošu kontrastvielu, lai labāk vizualizētu asinsvadus un veidojumus izmeklējamā organisma daļā.
MAGNĒTISKĀ REZONANSE (MR)
Izšķirtspēja izmeklējumam ir līdzīga KT. Izmeklējuma laikā pielieto vēnā ievadāmu kontrastvielu, bet tā nesatur jodu. MR pamatā ir nevis gamma starojums, bet magnētiskais lauks. Izmeklējums ir ilgāks nekā KT. MR nav izvēles metode plaušu vēža diagnostikā, bet noteiktās situācijās šai metodei ir priekšrocība, piemēram, alerģija pret jodu vai nepieciešamība izvērtēt noteiktus audus (galvas smadzenes, smadzeņu apvalkus, muguras smadzenes, kaulu/locītavu sistēmu, muskuļus).
POZITRONU EMISIJAS TOMOGRĀFIJA UN KOMPJŪTERTOMOGRĀFIJA (PET/KT)
Šis izmeklējums tiek veikts gandrīz visam ķermenim. Izmeklējuma laikā tiek apvienoti divi izmeklējumu veidi – zemo devu kompjūtertomogrāfija (KT) un pozitronu emisijas tomogrāfija (PET). KT ļauj noteikt audzēja anatomisku pozīciju, tā attiecību pret apkārtējiem orgāniem. PET norāda uz vielmaiņas aktivitāti audos. PET izmeklējuma laikā vēnā tiek ievadīta speciāla, glikozi saturoša, viela. Visātrāk un visvairāk šo vielu uzkrāj šūnas ar ļoti aktīviem vielmaiņas procesiem, un tādas ir ļaundabīgas šūnas. PET/KT (skat. attēlu tālāk) izmanto, nosakot sākotnējo plaušu vēža izplatību, to var veikt arī ārstēšanas efekta izvērtējumam. PET/KT palīdz precīzāk izvēlēties ārstēšanas taktiku.
PAPILDU ATTĒLDIAGNOSTIKAS METODES
Ja plaušu vēzis jau ir apstiprināts, ārsts var nozīmēt arī galvas KT vai MR, lai izslēgtu slimības izplatību galvas smadzenēs vai smadzeņu apvalkos. Kaulu scintigrāfiju var veikt, lai izvērtētu vai slimība nav skārusi kaulus. Tie var būt arī citu ķermeņa daļu izmeklējumi. Papildu izmeklējumu nepieciešamību individuāli katram pacientam izvērtē ārstējošais ārsts, vadoties pēc klīniskās ainas un citu izmeklējumu rezultātiem.
PLAUŠU VĒŽA PARAUGA MIKROSKOPISKAIS IZMEKLĒJUMS
Noteikt veidojumu plaušās var ar attēldiagnostikas metodēm, taču apstiprināt plaušu vēža diagnozi var tikai ar izmeklējumu mikroskopā – citoloģiju (atsevišķu šūnu parauga līmenī) vai histoloģiju (lielāka audu parauga līmenī). Mikroskopisku izmeklējumu veic ārsts patologs.
Audu paraugu mikroskopiskai izmeklēšanai var iegūt izmantojot dažādas metodes:
1. Bronhoskopija. Pacientam elpceļos ievada lokanu vai rigīdu zondi un ar tās palīdzību apskata elpceļus. Ja audzējs atrodas bronhā vai tuvu tam, no veidojuma paņem audu paraugu.
2. Plaušu biopsija kompjūtertomogrāfijas kontrolē. Metodi var izmantot, ja plaušu veidojums atrodas tuvu krūškurvja sienai. Kompjūtertomogrāfija parāda audzēja lokalizāciju, un caur krūškurvja sienu lokālā anestēzijā ar adatas palīdzību tiek paņemts audu paraugs.
3. Biopsija endobronhiālās ultrasonogrāfijas (EBUS) kontrolē. Metode pielietojama, ja ir aizdomas par plaušu vēža izplatību videnes limfmezglos. Elpceļos ievada speciālu zondi, ar ultrasonogrāfijas kameru sameklē patoloģiska izskata limfmezglus, no tiem ar adatu caur trahejas vai bronha sieniņu paņem audu paraugu. Līdzīgi limfmezglu paraugus var paņemt zondi ievadot caur barības vadu, jo barības vads no aizmugures cieši pieguļ trahejai.
4. Mediastinoskopija un torakoskopija. Tā ir operācija, kuras laikā caur nelieliem griezieniem ar speciāliem instrumentiem paņem audu paraugus no videnes limfmezgliem vai plaušu struktūrām. Šādu metodi var izvēlēties, ja ar citām metodēm audzēja paraugu iegūt neizdodas un ir aizdomas, ka plaušu vēzis ir izplatījies videnes limfmezglos, plaušu citās daļās vai pleirā. Operācija notiek vispārējā anestēzijā.
5. Ja plaušu vēzis izplatās pa pleiras lapiņām, sirds somiņas (perikarda) lapiņām, šajos dobumos uzkrājas vēža šūnu saražots šķidrums, kuru mikroskopiskai izmeklēšanai var iegūt ar pleiras telpas punkciju un šķidruma aspirāciju.
6. Ja plaušu vēža šūnas ir izplatījušās attālos orgānos un limfmezglos ārpus plaušām, ārsts var izšķirties arī no tām vietām paņemt audu paraugus mikroskopiskai izmeklēšanai. Dažkārt tas var mainīt tālāko ārstēšanas taktiku.
Iegūtos audzēja paraugus pēc atbilstošas apstrādes izmeklē mikroskopā. Citoloģijas (atsevišķu šūnu parauga) materiālā var apstiprināt ļaundabīga audzēja klātbūtni un bieži arī noteikt paveidu – sīkšūnu vai nesīkšūnu vēzis. Histoloģijas (lielāka audu parauga) materiālā ārsts patologs veic padziļinātu izmeklēšanu, ar speciālām krāsvielām paraugu krāsojot. Rezultātā tiek noteikts ne vien plaušu vēža paveids, bet arī citas īpašības: ļaundabīguma pakāpe (agresivitāte), dažādas vēža šūnu izdalītas molekulas, receptori, nepieciešamības gadījumā audu paraugā nosaka vēža šūnu mutācijas. Šie rezultāti palīdz izvēlēties katram pacientam atbilstošāku terapijas taktiku.
Kad pacientam ir apstiprināta plaušu vēža diagnoze, piemērotāko ārstēšanas taktiku izvēlas ārstu speciālistu komanda – onkoloģiskais konsīlijs. Onkoloģiskā konsīlija
komandā obligāti ir onkologs ķīmijterapeits, ķirurgs ar specializāciju onkoloģiskā ķirurģijā, terapeitiskais radiologs un diagnostiskais radiologs. Konsīlija komandai var pievienoties arī citi speciālisti – ārsts patologs, rehabilitologs un uztura speciālists, paliatīvās aprūpes ārsts u.c. Speciālistu komandas mērķis ir izvēlēties pacientam tādu terapijas plānu, kas sniegs vislielākos ieguvumus un radīs vismazāk ar terapiju saistītu blakņu. Plaušu vēža specifiskā ārstēšana var būt ar mērķi slimību izārstēt (radikāla) vai arī slimību uz laiku apturēt, pagarinot laika posmu bez slimības progresijas (paliatīva). Ārstēšanas veidus var iedalīt divās kategorijās:
1. Lokāla. Ārstēšanas veids darbojas vietā, kur to pielieto, piemēram, ķirurģiska operācija vai staru terapija.
2. Sistēmiska. Ārstēšanas līdzeklis izplatās pa visu organismu. Piemēram, medikamenti izplatās pa visu organismu ar asinsriti, bet visvairāk iedarbojas uz plaušu
vēža šūnām.
Plaušu vēža ārstēšanas taktiku izvēlas atkarībā no plaušu vēža tipa (sīkšūnu vai nesīkšūnu), stadijas, veidojumu skaita plaušās, pacienta vispārējā stāvokļa (ko novērtē pēc skalām ECOG vai Karnofska). Agrīnās stadijās terapijas mērķis ir slimību izārstēt, tāpēc svarīga ir ķirurģiska operācija. Ja slimība ir vairāk izplatīta, III–IV stadijā, izārstēšanos panākt var tikai atsevišķos gadījumos un terapijas galvenais mērķis ir slimību apturēt, tāpēc biežāk priekšroka ir medikamentozai ārstēšanai.
| pec ECOG skalas | pēc Karnofska skalas |
| 0 pilniba aktivs, spej veikt visas ikdienas aktivitates, slimiba to neierobežo |
100 nav nekadu sudzibu |
| 1 spej veikt vieglu fi zisku darbu – majas darbi vai biroja darbs, ierobežota intensiva fi ziska aktivitate |
90 minimali slimibas simptomi, pilniba saglabata ikdienas aktivitate 80 normala ikdienas aktivitate, ja nav nekadas fi ziskas piepules |
| 2 spej sevi aprupet, aktivs > 50% no dienas laika |
70 nevar veikt aktivu darbu, bet spej sevi aprupet 60 periodiski nepieciešama palidziba aprupe |
| 3 ierobežota sevis aprupes speja, aktivs < 50% no dienas laika |
50 nepieciešama aktiva palidziba ikdiena un aprupe 40 nepieciešama specializeta aprupe un palidziba |
| 4 gulošs, nav spejigs par sevi parupeties |
30 ļoti slims, nepieciešama hospitalizacija 20 nepieciešama intensiva uzturoša terapija stacionara |
Plaušu vēža specifiskā ārstēšana var būt ar mērķi slimību izārstēt (radikāla) vai arī slimību uz laiku apturēt, pagarinot laika posmu bez slimības progresijas (paliatīva). Ārstēšanas metodes un to kombinācijas var atšķirties nesīkšūnu un sīkšūnu plaušu vēža gadījumā.
Ārstēšanas veidus var iedalīt divās kategorijās:
1. Lokāli. Ārstēšanas veids darbojas vietā, kur to pielieto, piemēram, ķirurģiska operācija vai staru terapija.
2. Sistēmiski. Ārstēšanas līdzeklis izplatās pa visu organismu. Piemēram, medikamenti izplatās pa visu organismu ar asinsriti, bet visvairāk iedarbojas uz plaušu vēža šūnām. Lokāla plaušu vēža ārstēšana
ĶIRURĢISKA ĀRSTĒŠANA
Ķirurģisku ārstēšanu izvēlas, kad vien iespējams, kā potenciāli izārstējošo nesīkšūnu plaušu vēža gadījumā. Operācija ar izārstēšanas mērķi ir iespējama, ja plaušu vēzis ir 0–II stadijā un dažreiz III stadijā. Sīkšūnu plaušu vēža gadījumā operāciju izvēlas reti – simptomu atvieglošanai vai ļoti agrīnās stadijās. Sīkšūnu plaušu vēzis attīstās tuvu lielajiem elpceļiem, sasniedz lielu izmēru un ātri izplatās, tāpēc pilnībā izoperēt to visbiežāk nav iespējams. Plaušu vēža operācijas tiek veiktas vispārējā narkozē. Operāciju veic torakālais ķirurgs.
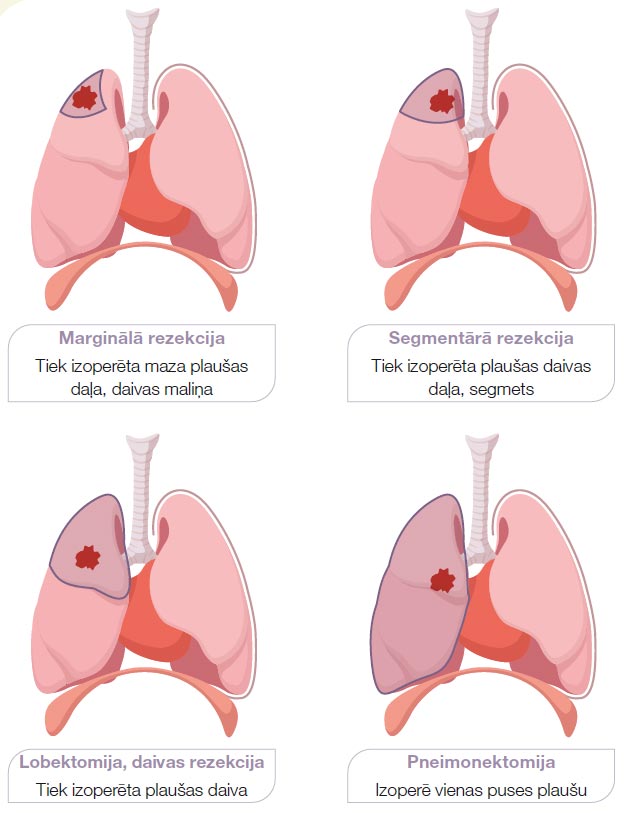
Ārstēšanas veidus var iedalīt divās kategorijās:
1. Lokāli. Ārstēšanas veids darbojas vietā, kur to pielieto, piemēram, ķirurģiska operācija vai staru terapija.
2. Sistēmiski. Ārstēšanas līdzeklis izplatās pa visu organismu. Piemēram, medikamenti izplatās pa visu organismu ar asinsriti, bet visvairāk iedarbojas uz plaušu vēža šūnām.
CITI LOKĀLAS ĀRSTĒŠANAS VEIDI
Krioablācija – metodes pamatā ir šķidrā slāpekļa sprejs, kas iesaldē audzēja šūnas, un ar laiku tās iet bojā. Tiek pielietota gadījumos, ja plaušu vēzis aug elpceļu iekšpusē un tos nosprosto, kā arī metode ir pieņemama 0. stadijas plaušu vēža gadījumā, kad audzējs ir ļoti virspusēji lokalizēts. Procedūru veic ar speciālas zondes palīdzību.
Elektrokoagulācija – lokālas terapijas metode, kuras pamatā ir karstumu ģenerējošs elektrods. Pievadot karstumu plaušu vēža šūnām, var apturēt asiņošanu no audzēja vai arī atbrīvot elpceļus, ja audzējs tos nosprosto.
CITOTOKSISKĀ ĶĪMIJTERAPIJA
Citotoksiskā (šūnām toksiskā) ķīmijterapija iedarbojas uz šūnas dalīšanās ciklu, dažādās fāzēs to bloķējot un neļaujot ļaundabīgai šūnai augt un vairoties. Tā kā ļaundabīgo šūnu vielmaiņas procesi ir daudz ātrāki par normālām organisma šūnām, ķīmijterapijas preparātus ļaundabīgās šūnas uzkrāj daudz ātrāk un lielākā daudzumā nekā veselie audi. Ķīmijterapija tiek piedāvāta pacientiem, kuru vispārējs stāvoklis ir pietiekami labs (ECOG 0–1, retāk 2), kam ķīmijterapijas ieguvumi ir lielāki par potenciāliem veselības riskiem un nav nopietnu nekontrolētu blakussaslimšanu. Ķīmijterapijas shēma un medikamentu kombinācijas tiek piemērotas, balstoties uz pacienta veselības stāvokli un terapijas mērķiem. Ir vairākas ķīmisko preparātu grupas. Plaušu vēža ārstēšanai pielieto platīnu, taksānu, topoizomerāzes inhibitoru, arī citu grupu medikamentus kombinācijās vai pa vienam. Ķīmijterapijas kursi atkārtojas ik pēc 1–4 nedēļām. Starp kursiem ir periods, kad zāles nav jāsaņem, tas ļauj veselajiem audiem atjaunoties un organismam atgūt spēkus. Ķīmijterapijas kurss var ilgt vienu vai vairākas dienas un aizņemt katru dienu vairākas stundas, tāpēc dažreiz ir nepieciešams terapiju saņemt stacionāra nodaļā. Ja pacientam ir ķīmijterapijas shēma, kuru var saņemt vienas dienas dažu stundu laikā, to var darīt dienas stacionāra apstākļos, kad nav jāpaliek ārstniecības iestādē pa nakti.
Latvijā šobrīd ir četras valsts klīnikas, kur ir pieejama staru terapija – Paula Stradiņa KUS, Rīgas Austrumu KUS, Daugavpils RS, Liepājas RS. Staru terapijas pamatā ir jonizējošais starojums, ko ģenerē speciāla iekārta – lineārais paātrinātājs. Starojums tiek ieprogrammēts trāpīt tieši ļaundabīgā audzēja šūnās. Staru terapijas kurss ilgst dienas līdz nedēļas katru darba dienu. Katra staru terapijas seansa laikā tiek pievadīta neliela starojuma deva – frakcija. Ar katru nākamo frakciju audzēja šūnās uzkrājas jonizējošā starojuma ietekme, kas izraisa vēža šūnu DNS dubultspirāles pārrāvumus un bojāeju. Staru terapiju pielieto gan audzējam plaušās, gan audzēja skartiem limfmezgliem, gan plaušu vēža metastāzēm citos orgānos. Staru terapiju atsevišķos gadījumos pielieto plaušu vēža pacientiem ar mērķi novērst galvas smadzeņu metastāžu attīstību.
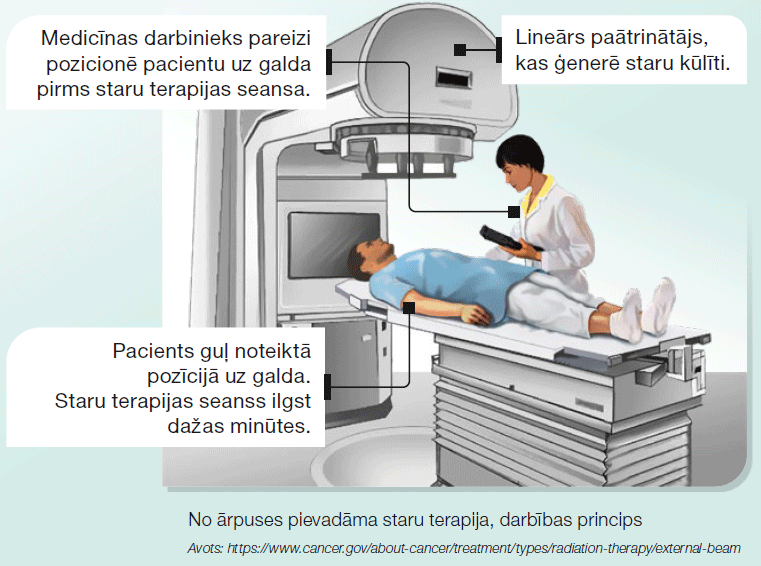
Plaušu vēža gadījumā visbiežāk pielieto no ārpuses pievadāmo staru terapiju (EBRT – External Beam Radiation therapy). Pacients tiek pozicionēts uz procedūru galda, un no ārpuses tiek pievadīts lineārā paātrinātāja ģenerēts staru kūlis (skat. attēlu). Pēc iespējas staru terapiju sinhronizē ar pacienta elpošanas kustībām. Ieelpas un izelpas laikā ar speciālo ierīci tiek piefiksētas krūškurvja kustības, staru kūlīša pievade tiek koriģēta, lai trāpītu precīzi audzēja šūnām bez elpošanas kustību radītas nobīdes.
Stereotaktiskas ablācijas terapija (SABR – stereotactic ablation radiotherapy) vai stereotaktiska radioķirurģija (SRS – stereotactic radiosurgery) atšķiras ar to, ka vienā apstarošanas reizē tiek pievadīta lielāka starojuma deva, kopējais staru terapijas kurss līdz ar to ir īsāks. Šīs staru terapijas metodes pielieto gadījumos, ja audzējs ir neliels un labi norobežots. Sīkšūnu plaušu vēža gadījumā, ja iepriekš pielietotās ārstēšanas rezultātā slimība neprogresē, pacientam var piedāvāt profilaktisku galvas smadzeņu apstarošanu, lai samazinātu galvas smadzeņu metastāžu attīstības risku.
Lai staru terapija noritētu ar mazāk komplikācijām, pacientam tiek sniegtas rekomendācijas par sagatavošanos un profilakses pasākumiem staru terapijas laikā, pēc tās. Rekomendācijas katram ir individuālas atkarība no audzēja lokalizācijas, lieluma, staru terapijas veida, pacienta blakusslimībām.
Ļaundabīgas šūnas staru terapijas ietekmē sabrūk, un to sabrukšanas produkti nonāk asinsritē, radot noguruma un nespēka sajūtu, tiek nomākta imunitāte. Šie simptomi parasti izzūd 1–2 mēnešu laikā pēc staru terapijas pabeigšanas. Staru terapijas laikā rekomendē sakārtot dienas režīmu, izvairīties no stresiem, ievērot pilnvērtīga uztura principus, regulāras pastaigas svaigā gaisā, lai organismā būtu pietiekami spēka šūnu atjaunošanai.
Līdz ar ļaundabīgām šūnām staru terapijas laikā jonizējošā starojuma ietekmē var iet bojā blakus esošo veselo audu šūnas:
Vietā, kur starojums iet caur ādu, var attīstīties ādas apsārtums, lobīšanās, dedzināšana, nieze. Tā izpaužās ādas apdegums no staru terapijas. Apdeguma kopšanai izmanto topiskus līdzekļus piem. uz pantenola bāzes. Pēc staru terapijas pabeigšanas ādas stāvoklis atjaunojas.
No jauna staru terapijas laikā parādījies sauss klepus vai elpas trūkums var liecināt par salīdzinoši retu staru terapijas blakusparādību – plaušu iekaisumu. Vieglos gadījumos tas pāriet pēc staru terapijas pabeigšanas, bet dažreiz var būt nepieciešama terapija ar pretiekaisuma medikamentiem un skābekļa atbalstu.
Ja staru lauks skar barības vadu, var parādīties barības vada gļotādas iekaisums. Var būt sāpīgāka rīšana, diskomforts aiz krūšu kaula. Šie simptomi pāriet pēc staru terapijas pabeigšanas. Lai mazinātu simptomus, rekomendē izvairīties no karsta ēdiena uzņemšanas, lietot mīkstu pārtiku, lietot pārklājošus līdzekļus staru terapijas laikā.
Ja staru terapija tiek pievadīta galvas smadzenēm pēc tās var parādīties atmiņas traucējumi, koncentrēšanās grūtības. Lai šīs komplikācijas novērstu pacientiem rekomendē staru terapijas laikā uzturēt galvas smadzeņu aktivitāti, ievērot citas vispārējās veselīga dzīvesveida rekomendācijas.
3. Medikamentoza ārstēšana
Sistēmiska jeb medikamentoza terapija ir ļoti svarīga plaušu vēža ārstēšanā. Tādās plaušu vēža stadijās, kad izārstējoša lokāla terapija nav iespējama – audzējs ir izplatījies plaši lokāli un reģionāli (III stadija) vai arī citos orgānos (IV stadija), medikamentozai terapijai ir īpaši liela nozīme. Sistēmisku terapiju var nozīmēt pirms operācijas ar mērķi samazināt plaušu audzēja izmēru un attiecīgi operācijas apjomu. Pēc operācijas medikamentozu terapiju nozīmē ar mērķi samazināt plaušu vēža recidīva risku. Sistēmisku terapiju var nozīmēt kopā vai secīgi ar staru terapiju. Sistēmiska terapija var būt arī kā vienīgais plaušu vēža ārstēšanas veids. Sistēmiskas terapijas laikā un pēc tās pacientu novēro onkologs ķīmijterapeits.
Ķirurģisku ārstēšanu izvēlas, kad vien iespējams, kā potenciāli izārstējošo nesīkšūnu plaušu vēža gadījumā. Operācija ar izārstēšanas mērķi ir iespējama, ja plaušu vēzis ir 0–II stadijā un dažreiz III stadijā. Sīkšūnu plaušu vēža gadījumā operāciju izvēlas reti – simptomu atvieglošanai vai ļoti agrīnās stadijās. Sīkšūnu plaušu vēzis attīstās tuvu lielajiem elpceļiem, sasniedz lielu izmēru un ātri izplatās, tāpēc pilnībā izoperēt to visbiežāk nav iespējams. Plaušu vēža operācijas tiek veiktas vispārējā narkozē. Operāciju veic torakālais ķirurgs.
Operācijas materiālu, audzēju un izoperētus limfmezglus ķirurgs nosūta mikroskopiskai izmeklēšanai. Pēc mikroskopiskas izmeklēšanas tiek izsniegts slēdziens, vai plaušu vēzis ir pilnībā izoperēts, vai tā izgriešanas līnijās ir palikušas vēža šūnas un vai slimība ir skārusi izoperētos limfmezglus. Atkarībā no operācijas materiāla īpašībām tiek izlemta turpmāka ārstēšanas taktika – atkārtota operācija, pēcoperācijas medikamentoza terapija vai staru terapija, vai arī šo terapijas metožu kombinācija, vai arī novērošana. Lēmumu par turpmāko taktiku pieņem onkoloģiskā konsīlija ārstu komanda.
Plaušu operācija ir liela ķirurģiska manipulācija, kas ir saistīta ar zināmiem riskiem un iespējamām komplikācijām. Riski pieaug līdz ar operācijas apjomu un iekļauj reakciju uz anestēziju, asiņošanu, dziļo vēnu trombozi, brūču infekcijas, plaušu iekaisumu.
Atkopšanās periods pēc plaušu operācijas ilgst nedēļas līdz mēnešus. Ja operācija tiek veikta ar lielu griezienu krūškurvja sienā, tad kādu laiku pēc operācijas var būt nepieciešama pretsāpju terapija, jo operācijas laikā tiek atbīdītas ribas. Ja plaušu stāvoklis pacientam pirms operācijas ir labs, nav hronisku plaušu slimību, tad pat pēc visas plaušas izņemšanas ar laiku pacients var atgriezties pie pilnīgi normāla ikdienas aktivitātes līmeņa un darbaspējām. Savukārt, ja ir hroniskas plaušu slimības kā emfizēma, hronisks smēķētāja bronhīts, tad pēc operācijas var parādīties nepārejošs elpas trūkums pie fiziskās slodzes. Operācijas riskus izvērtē, balstoties uz pacienta vispārējo stāvokli, blakusslimībām, asins analīzēm un pirms operācijas veiktiem elpošanas funkcijas testiem. Sekojoši torakālais ķirurgs pieņem lēmumu par operācijas apjomu un iespējām.
CITI LOKĀLĀS ĀRSTĒŠANAS VEIDI
Krioablācija – metodes pamatā ir šķidrā slāpekļa sprejs, kas iesaldē audzēja šūnas, un ar laiku tās iet bojā. Tiek pielietota gadījumos, ja plaušu vēzis aug elpceļu iekšpusē un tos nosprosto, kā arī metode ir pieņemama 0. stadijas plaušu vēža gadījumā, kad audzējs ir ļoti virspusēji lokalizēts. Procedūru veic ar speciālas zondes palīdzību.
Elektrokoagulācija – lokālas terapijas metode, kuras pamatā ir karstumu ģenerējošs elektrods. Pievadot karstumu plaušu vēža šūnām, var apturēt asiņošanu no audzēja vai arī atbrīvot elpceļus, ja audzējs tos nosprost
Latvijā šobrīd ir četras valsts klīnikas, kur ir pieejama staru terapija – Paula Stradiņa KUS, Rīgas Austrumu KUS, Daugavpils RS, Liepājas RS. Staru terapijas pamatā ir jonizējošais starojums, ko ģenerē speciāla iekārta – lineārais paātrinātājs. Starojums tiek ieprogrammēts trāpīt tieši ļaundabīgā audzēja šūnās. Staru terapijas kurss ilgst dienas līdz nedēļas katru darba dienu. Katra staru terapijas seansa laikā tiek pievadīta neliela starojuma deva – frakcija. Ar katru nākamo frakciju audzēja šūnās uzkrājas jonizējošā starojuma ietekme, kas izraisa vēža šūnu DNS dubultspirāles pārrāvumus un bojāeju. Staru terapiju pielieto gan audzējam plaušās, gan audzēja skartiem limfmezgliem, gan plaušu vēža metastāzēm citos orgānos. Staru terapiju atsevišķos gadījumos pielieto plaušu vēža pacientiem ar mērķi novērst galvas smadzeņu metastāžu attīstību.
Staru terapiju var pielietot:
1. operācijas vietā;
2. pēc iepriekš veiktās operācijas ar mērķi iznīcināt palikušas ar aci neredzamas plaušu vēža šūnas;
3. pēc iepriekš saņemtās medikamentozas terapijas;
4. vienlaicīgi ar medikamentu saņemšanu;
5. plaušu vēža metastāžu ārstēšanai;
6. jebkurā slimības etapā audzēja radītu simptomu atvieglošanai – blakusorgānu vai asinsvadu saspiešana, sāpes.
Plaušu vēža gadījumā visbiežāk pielieto no ārpuses pievadāmo staru terapiju (EBRT – External Beam Radiation therapy). Pacients tiek pozicionēts uz procedūru galda, un no ārpuses tiek pievadīts lineārā paātrinātāja ģenerēts staru kūlis (skat. attēlu). Pēc iespējas staru terapiju sinhronizē ar pacienta elpošanas kustībām. Ieelpas un izelpas laikā ar speciālo ierīci tiek piefiksētas krūškurvja kustības, staru kūlīša pievade tiek koriģēta, lai trāpītu precīzi audzēja šūnām bez elpošanas kustību radītas nobīdes.
Stereotaktiskas ablācijas terapija (SABR – stereotactic ablation radiotherapy) vai stereotaktiska radioķirurģija (SRS – stereotactic radiosurgery) atšķiras ar to, ka vienā apstarošanas reizē tiek pievadīta lielāka starojuma deva, kopējais staru terapijas kurss līdz ar to ir īsāks. Šīs staru terapijas metodes pielieto gadījumos, ja audzējs ir neliels un labi norobežots. Sīkšūnu plaušu vēža gadījumā, ja iepriekš pielietotās ārstēšanas rezultātā slimība neprogresē, pacientam var piedāvāt profilaktisku galvas smadzeņu apstarošanu, lai samazinātu galvas smadzeņu metastāžu attīstības risku.
Lai staru terapija noritētu ar mazāk komplikācijām, pacientam tiek sniegtas rekomendācijas par sagatavošanos un profilakses pasākumiem staru terapijas laikā, pēc tās. Rekomendācijas katram ir individuālas atkarība no audzēja lokalizācijas, lieluma, staru terapijas veida, pacienta blakusslimībām.
Ļaundabīgas šūnas staru terapijas ietekmē sabrūk, un to sabrukšanas produkti nonāk asinsritē, radot noguruma un nespēka sajūtu, tiek nomākta imunitāte. Šie simptomi parasti izzūd 1–2 mēnešu laikā pēc staru terapijas pabeigšanas. Staru terapijas laikā rekomendē sakārtot dienas režīmu, izvairīties no stresiem, ievērot pilnvērtīga uztura principus, regulāras pastaigas svaigā gaisā, lai organismā būtu pietiekami spēka šūnu atjaunošanai.
Līdz ar ļaundabīgām šūnām staru terapijas laikā jonizējošā starojuma ietekmē var iet bojā blakus esošo veselo audu šūnas:
Vietā, kur starojums iet caur ādu, var attīstīties ādas apsārtums, lobīšanās, dedzināšana, nieze. Tā izpaužās ādas apdegums no staru terapijas. Apdeguma kopšanai izmanto topiskus līdzekļus piem. uz pantenola bāzes. Pēc staru terapijas pabeigšanas ādas stāvoklis atjaunojas.
No jauna staru terapijas laikā parādījies sauss klepus vai elpas trūkums var liecināt par salīdzinoši retu staru terapijas blakusparādību – plaušu iekaisumu. Vieglos gadījumos tas pāriet pēc staru terapijas pabeigšanas, bet dažreiz var būt nepieciešama terapija ar pretiekaisuma medikamentiem un skābekļa atbalstu.
Ja staru lauks skar barības vadu, var parādīties barības vada gļotādas iekaisums. Var būt sāpīgāka rīšana, diskomforts aiz krūšu kaula. Šie simptomi pāriet pēc staru terapijas pabeigšanas. Lai mazinātu simptomus, rekomendē izvairīties no karsta ēdiena uzņemšanas, lietot mīkstu pārtiku, lietot pārklājošus līdzekļus staru terapijas laikā.
Ja staru terapija tiek pievadīta galvas smadzenēm pēc tās var parādīties atmiņas traucējumi, koncentrēšanās grūtības. Lai šīs komplikācijas novērstu pacientiem rekomendē staru terapijas laikā uzturēt galvas smadzeņu aktivitāti, ievērot citas vispārējās veselīga dzīvesveida rekomendācijas.
Sistēmiska jeb medikamentoza terapija ir ļoti svarīga plaušu vēža ārstēšanā. Tādās plaušu vēža stadijās, kad izārstējoša lokāla terapija nav iespējama – audzējs ir izplatījies plaši lokāli un reģionāli (III stadija) vai arī citos orgānos (IV stadija), medikamentozai terapijai ir īpaši liela nozīme. Sistēmisku terapiju var nozīmēt pirms operācijas ar mērķi samazināt plaušu audzēja izmēru un attiecīgi operācijas apjomu. Pēc operācijas medikamentozu terapiju nozīmē ar mērķi samazināt plaušu vēža recidīva risku. Sistēmisku terapiju var nozīmēt kopā vai secīgi ar staru terapiju. Sistēmiska terapija var būt arī kā vienīgais plaušu vēža ārstēšanas veids. Sistēmiskas terapijas laikā un pēc tās pacientu novēro onkologs ķīmijterapeits.
CITOTOKSISKĀ ĶĪMIJTERAPIJA
Citotoksiskā (šūnām toksiskā) ķīmijterapija iedarbojas uz šūnas dalīšanās ciklu, dažādās fāzēs to bloķējot un neļaujot ļaundabīgai šūnai augt un vairoties. Tā kā ļaundabīgo šūnu vielmaiņas procesi ir daudz ātrāki par normālām organisma šūnām, ķīmijterapijas preparātus ļaundabīgās šūnas uzkrāj daudz ātrāk un lielākā daudzumā nekā veselie audi. Ķīmijterapija tiek piedāvāta pacientiem, kuru vispārējs stāvoklis ir pietiekami labs (ECOG 0–1, retāk 2), kam ķīmijterapijas ieguvumi ir lielāki par potenciāliem veselības riskiem un nav nopietnu nekontrolētu blakussaslimšanu. Ķīmijterapijas shēma un medikamentu kombinācijas tiek piemērotas, balstoties uz pacienta veselības stāvokli un terapijas mērķiem. Ir vairākas ķīmisko preparātu grupas. Plaušu vēža ārstēšanai pielieto platīnu, taksānu, topoizomerāzes inhibitoru, arī citu grupu medikamentus kombinācijās vai monoterapijā. Ķīmijterapijas kursi atkārtojas ik pēc 1–4 nedēļām. Starp kursiem ir periods, kad zāles nav jāsaņem, tas ļauj veselajiem audiem atjaunoties un organismam atgūt spēkus. Ķīmijterapijas kurss var ilgt vienu vai vairākas dienas un aizņemt katru dienu vairākas stundas, tāpēc dažreiz ir nepieciešams terapiju saņemt stacionāra nodaļā. Ja pacientam ir ķīmijterapijas shēma, kuru var saņemt vienas dienas dažu stundu laikā, to var darīt dienas stacionāra apstākļos, kad nav jāpaliek ārstniecības iestādē pa nakti. Kopējais ķīmijterapijas kursu skaits ir atkarīgs no plaušu vēža stadijas, izvēlētās terapijas shēmas un pacienta veselības stāvokļa. Parasti kīmijterapija tiek turpināta dažus mēnešus, sekojoši tiek veikti kontroles izmeklējumi, lai izvērtētu terapijas efektu. Precīzi par terapijas ilgumu un kursu skaitu ir jājautā ārstējošam onkologam ķīmijterapeitam. Ķīmijterapiju var kombinēt ar citiem pretvēža medikamentiem, piemēram, imūnterapiju.
Ķīmijterapija novājina organisma imūno sistēmu, tāpēc dažas nedēļas pirms ķīmijterapijas uzsākšanas rekomendē apmeklēt zobārstu, iziet obligāto vakcināciju, plaušu vēža pacientiem rekomendē vakcinēties pret gripu atbilstošā sezonā un pret pneimokokiem (mikroorganismiem, kas izraisa plaušu infekciju), kā arī vakcinēties pret COVID-19. Pirms ķīmijterapijas uzsākšanas pacientam obligāti nozīmē asins analīzes, novērtē vispārējo stāvokli, aknu un nieru funkciju. Pirms katra nākamā ķīmijterapijas kursa tiek veiktas jaunas asins analīzes, lai ārsts izvērtē, vai drīkst sistēmisko terapiju turpināt pēc plāna vai ir jāļauj organismam nedaudz ilgāk atpūsties. Smēķējošiem pacientiem stingri rekomendē pārtraukt smēķēšanu, jo tā būtiski samazina ārstēšanas efektu. Pieeju ķīmijterapijas ievadei visbiežāk nodrošina caur venozo katetru, ko medmāsa ievieto kādā no rokas vēnām katru reizi pacientam atnākot uz ķīmijterapijas kursu. Ir arī citi intravenozas pieejas veidi, piemēram, zemādā implantējams porta katetrs. Katetram ir rezervuārs, kurā ar adatas palīdzību veic medikamentu ievadi, bet katetra gals savienojas ar lielu vēnu. Porta katetrs tiek ievietots zemādā un netraucē ikdienas aktivitātes, higiēnas procedūras.
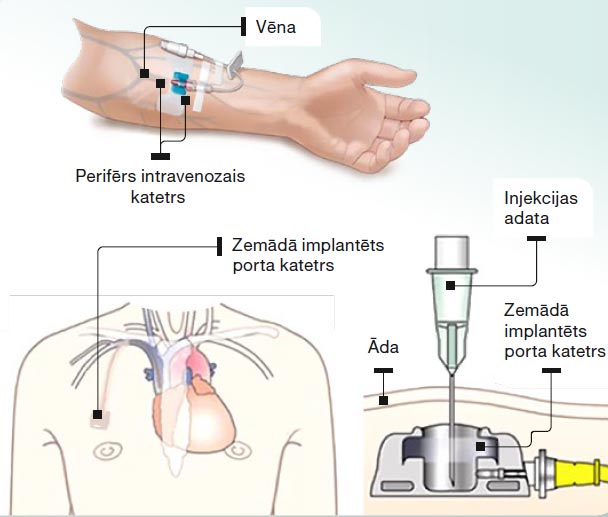
Intravenozas pieejas veidi imijterapijas ievadei
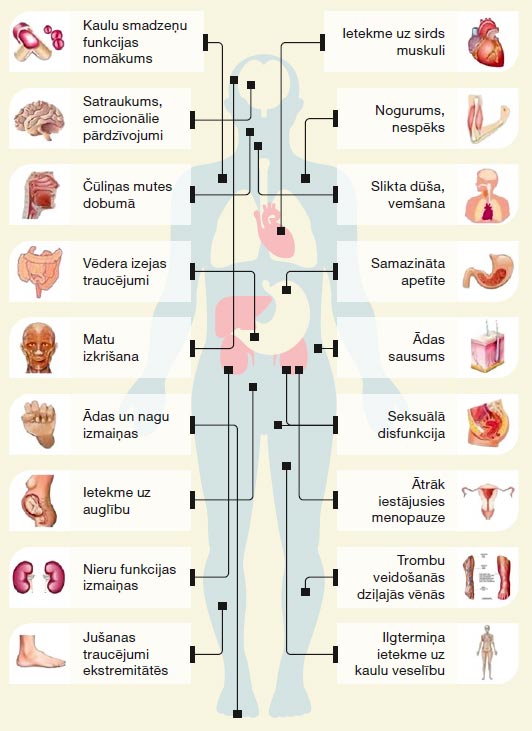
Pirms katras ķīmijterapijas ievades pacients vēnā saņem zāles pret alerģiju un sliktu dūšu. Šie medikamenti var izraisīt miegainību, tāpēc ķīmijterapijas saņemšanas dienā nerekomendē vadīt automašīnu un ir vēlams būt tuvinieka pavadībā, dodoties mājās. Ķīmijterapija visātrāk un visintensīvāk uzkrājas vēža šūnās, jo tās ātrāk aug un vairojas. Tomēr, izplatoties ar asinsriti pa visu organismu, ķīmijterapija ietekmē arī veselos audus ar aktīviem vielmaiņas procesiem – kaulu smadzeņu šūnas, gremošanas traktu izklājošās šūnas, matu folikulu šūnas, dzimumšūnas. Ietekme uz šīm šūnām nosaka ķīmijterapijas blakņu profilu. Tikai 5–10 % pacientu rodas nopietnas blaknes, kuru ārstēšana notiek slimnīcas stacionārā. Ķīmijterapijas blaknes pāriet dažu dienu līdz mēnešu laikā pēc ķīmijterapijas pabeigšanas, un tikai neliela daļa var būt paliekošas. Biežākās blaknes ir nogurums, slikta dūša un vemšana dažas dienas pēc ķīmijterapijas, apetītes izmaiņas, vēdera izejas traucējumi, dažādas intensitātes matu izkrišana, anēmija, infekcijas risks.
Iespējamās ķīmijterapijas blakusparādības.
Mērķterapija
Ķīmijterapijas medikamentu blakusparādību profils un rezistence pret zālēm likusi pētniekiem meklēt arvien jaunas ārstēšanas pieejas. Mērķterapija ir medikamenti, kuri iedarbojas uz specifiskiem audzēja gēniem, proteīniem, augšanas faktoriem vai ietekmē audzēja vidi. Mērķterapijas preparātu klāsts kļūst aizvien plašāks, kas ļauj panākt efektīvāku un specifiskāku vēža terapiju. Tablešu forma atvieglo šīs terapijas pielietojumu.
Mērķterapijas preparāti bloķē noteiktu molekulu vai receptoru vēža šūnā. Lielāko daļu mērķterapijas nozīmē tikai, ja plaušu vēža audu parauga šūnās ir atrasta speciāla mutācija. Nesīkšūnu plaušu vēža terapijā lielākā mērķpreparātu grupa ir tirozīnkināzes inhibitori (TKI). Tirozīnkināzes ir enzīmi, kuri veselā organismā vajadzības gadījumā stimulē šūnas augšanu un dalīšanos. Līdz 15% nesīkšūnu plaušu vēža gadījumu (pārsvarā adenokarcinomās) notiek tirozīnkināžu receptoru gēnu bojājums, mutācija. Tas izraisa šūnas nekontrolētu augšanu un dalīšanos. Mutācijas biežāk tiek konstatētas pacientiem ar plaušu adenokarcinomu, sievietēm, nesmēķētājiem, aziātiem. Bloķējot bojātos receptorus ar mērķterapijas preparātiem, vēža šūnas zaudē spēju dalīties, audzējs pārstāj augt. Tādēļ audzēju paraugus ir nepieciešams testēt, lai atrastu katram pacientiem vispiemērotāko terapiju.

EGFR
Epidermālā augšanas faktora receptors (Epithelial Growth Factor Receptor, EGFR) ir proteīns, kas atrodas uz šūnu virsmas. Šis receptors veselām šūnām palīdz augt un dalīties. Ja notikusi EGFR gēna mutācija, notiek pastiprināta šūnu aktivācija un dalīšanās, un sākas nekontrolēta šūnu augšana. EGFR mutācijas atrod apmēram 10 – 15% pacientu ar NSŠPV. Pacientiem, kuriem ir pierādītas specifiskas EGFR mutācijas, terapijā izmanto EGFR tirozīnkināzes inhibitorus.
ALK
ALK jeb anaplastiskas limfomas kināzes mutācijas atrod apmēram 5% gadījumu pacientiem ar NSŠPV. ALK gēnu mutācijas gadījumā notiek pastiprināta šūnu dalīšanās, jo tiek aktivizēti šūnu iekšējie procesi. Kā rezultātā šūnas zaudē kontroli un sākt uzkrāties organismā. Ja pacientam tiek pierādīta ALK gēna izmaiņas, tad šie pacientiem terapijā var izmantot ALK inhibitorus jeb bloķētājus.
ROS1
ROS1 gēna izmaiņas atrod 1-2% no NSŠPV pacientiem. Visbiežāk to atrod pacientiem, kur nav smēķētāji un kuriem ir pierādīta plaušu adenokarcinoma. ROS gēna bojājuma gadījumā līdzīgi kā pie ALK mutācijām šūnas zaudē kontroli un sāk pastiprināti dalīties. ROS mutāciju gadījumā pacientiem var izmantot specifisku mērķterapiju – tirozīnkināzes inhibitorus.
BRAF
BRAF V600E mutācija atrod 1-2% pacientiem ar NSŠPV. BRAF ir svarīgs šūnu proteīnu aktivētājs. Mutāciju gadījumā šūnas sāk pastiprināti veidot proteīnus, kas noved pie šūnu pastiprinātas veidošanās un izplatīšanās. BRAF mutācijas gadījumā var tikt pielietoti BRAF inhibitori.
NTRK
NTRK saplūšanas gēna izveidošanās ir sastopama reti, tikai 0,1% gadījumu. Mūsdienās ir pieejami medikamenti, kuri ir mērķēti tieši uz šo mutāciju.
VEGF
Audzēja augšanai nepieciešami jauni asinsvadi, kas audzēju apgādā ar skābekļi un barības vielām. Šo procesu sauc par angioģenēzi. Audzējs izdala vielas, ko sauc par asinsvadu augšanas faktoriem (Vascular Endothelial Growth Factor jeb VEGF), kas veicina angioģenēzes procesu. VEGF inhibitori ir zāles, kas bloķē jaunu sīko asinsvadu veidošanos audzēja masā, tādā veidā samazinot augšanai nepieciešamo vielu piegādi audzēja šūnām. VEGF inhibitori ir pielietojami nesīkšūnu plaušu vēža ārstēšanai kombinācijā ar citotoksisku ķīmijterapiju vai cita veida mērķterapiju. Ja audzējs reaģē uz šādu kombināciju, tad VEGF inhibitorus dažreiz turpina kā uzturošu terapiju pēc ķīmijterapijas pabiegšanas līdz audzēja progresijai.
Imūnterapija
Imūnterapija ir inovatīva ārstēšanas metode. Imūnterapija palīdz organisma imunitātei atpazīt un noārdīt plaušu vēža šūnas, uzturot limfocītu aktivāciju caur speciālo receptoru bloķēšanu (skat. bildi).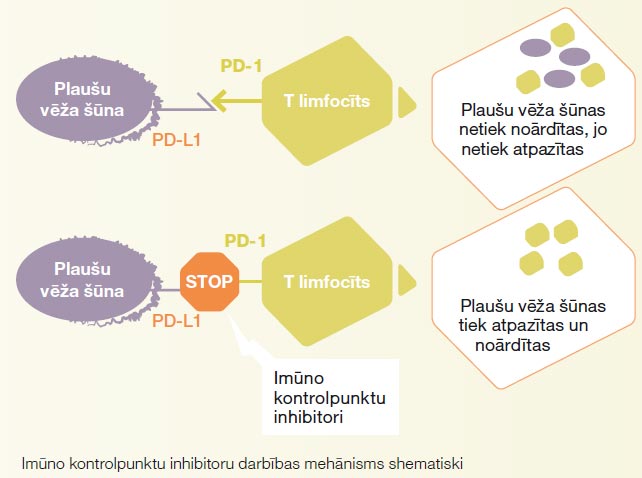

*Eiropas onkologu imijterapeitu asociacijas (ESMO) majaslapa ir pieejams informativs buklets par imunterapijas iespejamam blakusparadibam.
https://www.esmo.org/content/download/391766/7626038/1/LV-Imunterapijas-Blaknes-Noradijumi-Pacientiem.pdf
Imūnterapija ir inovatīva ārstēšanas metode. Imūnterapija palīdz organisma imunitātei atpazīt un noārdīt plaušu vēža šūnas, uzturot limfocītu aktivāciju caur speciālo receptoru bloķēšanu..
Imūnterapiju pielieto plaši izplatīta vai metastātiska plaušu vēža ārstēšanai, kad nav iespējama efektīva lokāla terapija. Imūnterapija var tikt pielietota kā vienīgais medikaments, vai kombinācijā ar ķīmijterapiju. Lai novērtētu potenciālo imūnterapijas efektivitāti, veic PD-L1 receptoru noteikšanu plaušu vēža audu paraugā. Imūnterapijas medikamenti tiek ievadīti intravenozi ik 2–6 nedēļas.
Pretēji citotoksiskai ķīmijterapijai imūnterapija stimulē, nevis nomāc organisma imunitāti, tāpēc arī imūnterapijas blakusparādības ir saistītas nevis ar imunitātes novājināšanu, bet ar tās stimulāciju. Imunitātes stimulācija var notikt ne tikai pret vēža šūnām, bet arī pret organisma normālām šūnām. Tas izpaužas kā iekaisums, ko organisms izraisa pats pret sevi: ādas iekaisums (dermatīts), locītavu iekaisums (artrīts), vairogdziedzera iekaisums (tireoidīts), zarnu iekaisums (kolīts), plaušu iekaisums (pneimonīts) u.c. (skat. tabulu) Imūnterapijas blakusparādības, ja parādās, tad visbiežāk pirmo trīs mēnešu laikā no terapijas sākuma. Blakusparādības iedala smaguma pakāpēs, un visbiežāk novēro viegli- vidēji izteiktas blakusparādības. Tās ir labi ārstējamas ar kortikosteoīdiem – pretiekaisuma medikamentiem tablešu vai injekciju veidā.
Imūno kontrolpunktu inhibitoru blakusparādības
Nogurums, nespēks
Vadīšana/ārstēšana: sakārtot dienas un miega režīmu, biežāk pastaigas svaigā gaisā, adekvāts uzturs un šķidruma uzņemšana dienas laikā.
Ādas izsitumi (dermatīts), nieze
Simptomi: sārti izsitumi dažādās ķermeņa daļās ar/bez niezes.
Vadīšana/ārstēšana: antihistamīnie līdzekļi topiski vai tabletēs niezes mazināšanai, kortikosteroīdu ziedes. Smagākas pakāpes ādas izsitumiem tiek nozīmēta kortikosteroīdu terapija. Ja izsitumi ir viegli vai mazinās, imūnterapiju var turpināt. Ir jāsargā āda no bojājumiem, tiešiem saules stariem.
Vairogdziedzera iekaisums (tireoidīts)
Simptomi: vairogdziedzera hiperfunkcijas gadījumā svīšana, sirdsklauves, nervozitāte, bezmiegs, caureja, ātra sirdsdarbība, svara zudums. Vairogdziedzera hipofunkcijas gadījumā –nogurums, svara pieaugums, aizcietējumi, lēnīgums un salīgums.
Vadīšana/ārstēšana: kortikosteroīdi, vairogdziedzera hormonu terapija endokrinologa uzraudzībā. Imūnterapiju pārtrauc līdz vairogdziedzera funkcija tiek stabilizēta.
Zarnu iekaisums (kolīts), caureja
Simptomi: bieža šķidra vēdera izeja ar/bez asiņu piejaukuma, sāpes vēderā, slikta dūša, atūdeņošanās simptomi (pieaugošs nespēks, paātrināta sirdsdarbība, pazemināts asinsspiediens).
Vadīšana/ārstēšana: adekvāta šķidruma un elektrolītu uzņemšana, kortikosteroīdi, kolonoskopijas izmeklējums zarnu iekaisuma precizēšanai gastroenterologa uzraudzībā. Vidēji smaga un smaga zarnu iekaisuma gadījumā imūnterapiju pārtrauc uz laiku vai pilnībā, smaga zarnu iekaisuma ārstēšana notiek slimnīcas stacionārā gastroenterologa uzraudzībā.
Plaušu audu iekaisums (pneimonīts)
Simptomi: no jauna parādījies sauss klepus vai elpas trūkums, kas ar laiku pasliktinās.
Vadīšana/ārstēšana: ar kompjūtertomogrāfijas izmeklējumu apstiprina izmaiņas plaušās, tiek pārtraukta imūnterapija un tiek uzsākta kortikosteroīdu terapija, antibakteriāla terapija. Smaga pneimonīta gadījumā var būt nepieciešama ārstēšana stacionārā, pneimonologa uzraudzībā.
Aknu iekaisums (hepatīts)
Simptomi: Viegls hepatīts var būt bez simptomiem, izmaiņas tikai asins analīzēs (ALAT, ASAT, bilirubīns). Smaga hepatīta gadījumā var būt apetītes zudums, vēdera pūšanās, caureja, ādas nieze, muskuļu sāpes, bet simptomu var arī nebūt.
Vadīšana/ārstēšana: viegla hepatīta gadījumā turpina terapiju, kontrolējot asins analīžu izmaiņas, vidēji smaga un smaga hepatīta gadījumā imūnterapija tiek uz laiku vai pilnībā pārtraukta, ārsts nozīmē kortikosteroīdus iekaisuma mazināšanai.
Hipofīzes iekaisums (hipofizīts)
Ļoti reta imūnterapijas toksicitāte.
Simptomi: viegls hipofizīts var noritēt bez simptomiem, vidēji smaga un smaga hipofizīta gadījumā var parādīties redzes traucējumi, galvassāpes, izteiktas slāpes, palielināts urīna daudzums u.c. no jauna parādījušies simptomi.
Vadīšana/ārstēšana: kortikosteroīdi iekaisuma mazināšanai, aizvietojošā hormonterapija, var būt nepieciešams pārtraukt imūnterapiju. Tiek nozīmēti papildu testi hipofīzes hormonu noteikšanai.
Ir tādas imūnterapijas blakusparādības, kas izpaužas pavisam reti. Muskuļu vājums, roku un kāju jušanas izmaiņas vai tirpšana var būt nervu sistēmas toksicitātes izpausmes. Vadīšanā lieto kortikosteroīdus līdz brīdim, kamēr simptomi mazinās vai pāriet. Reimatoloģiska toksicitāte var izpausties ar sāpēm locītavās (artrīts) vai muskuļos. Sāpēm ārsts var nozīmēt pretiekaisuma un pretsāpju līdzekļus, kā arī kortikosteroīdus. Var būt nepieciešama reimatologa konsultācija un papildu imūnsupresīva terapija. Ja imūnterapijas blakusefekti ir izteikti un traucē dzīves kvalitāti, terapiju pārtrauc.
*Eiropas onkologu ķīmijterapeitu asociācijas (ESMO) mājaslapā ir pieejams informatīvs buklets par imūnterapijas iespējamām blakusparādībām.
https://www.esmo.org/content/ download/391766/7626038/1/LV-Imunterapijas-Blaknes-Noradijumi-Pacientiem.pdf
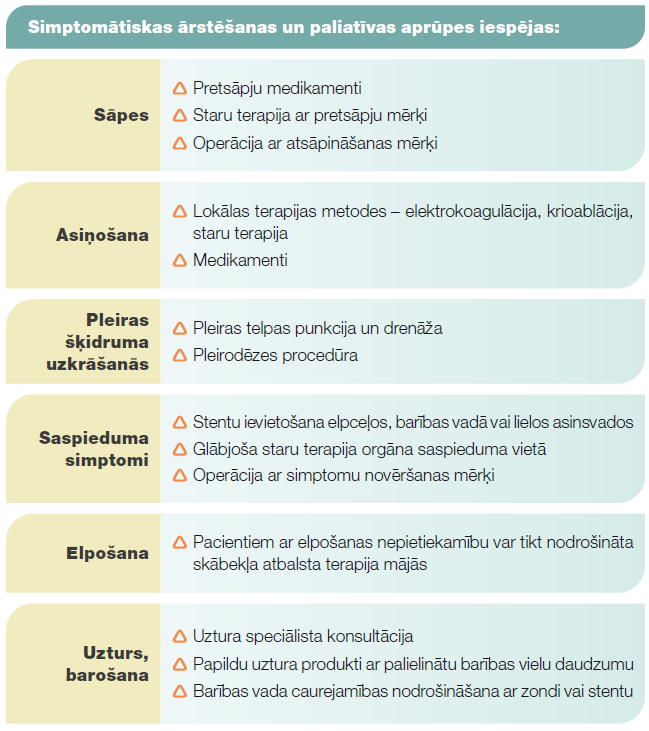
Simptomātiska terapija un paliatīva aprūpe
Tā ir nespecifiska plaušu vēža ārstēšana. Simptomātiskas terapijas un paliatīvas aprūpes mērķis ir uzlabot pacienta dzīves kvalitāti, atvieglot vai novērst plaušu vēža radītus simptomus. Simptomātiska terapija var tikt nodrošināta vienlaicīgi ar specifisku plaušu vēža ārstēšanu - staru terapiju, medikamentozu terapiju, operāciju, vai arī pēc tās pabeigšanas. Atsevišķos gadījumos specifiska plaušu vēža terapija nav iespējama pacienta vispārēji apgrūtināta stāvokļa dēļ, terapija priekš pacienta var būt pārāk smaga vai arī pacients no specifiskās ārstēšanas atsakās. Simptomātisku terapiju un paliatīvu aprūpi nodrošina ģimenes ārsts un paliatīvās aprūpes speciālists. Nepieciešamības gadījumā ārstēšanai tiek piesaistīti speciālisti, kas var veikt manipulācijas simptomu atvieglošanai. Enterāla un parenterāla uztura nodrošināšana ir nepieciešama pacientiem ar nepietiekamu barojumu. Par uzturu pacients var saņemt ārsta dietologa konsultāciju uztura kabinetā, ārstējošais ārsts var rekomendēt papildu uztura produktus. Elpceļu caurejamības nodrošināšanai un asiņošanas kontrolei var izmantot lokālās terapijas metodes: elektrokoagulāciju, krioablāciju, elpceļu caurlaidības atjaunošanu ar stentu. Šīs procedūras veic torakālais ķirurgs. Dažiem pacientiem var būt nepieciešama skābekļa atbalsta terapija, ko ar skābekļa koncentrātora palīdzību var nodrošināt mājas apstākļos. Pacientiem ar izplatītu plaušu vēzi starp pleiras lapiņām var uzkrāties šķidrums. Tas var apgrūtināt elpošanu. Lai to atrisinātu, veic pleiras telpas punkciju un šķidruma drenāžu. Ja šķidrums krājas atkārtoti, ir iespēja veikt procedūru, kuras laikā pleiras lapiņas salipina savā starpā ar speciālo talka pulveri - talka pleirodēzi. Rezultātā starp pleiras lapiņām šķidrums neuzkrājas. Ja plaušu vēzis vai vēža skartie limfmezgli cauraug barības vada sieniņu, var būt apgrūtināta rīšana. Barības vada caurejamību var atjaunot ar stenta ievietošanu. Slimības radītu sāpju gadījumā atbilstoši sāpju intensitātei un raksturam nozīmē pretsāpju medikamentus. Piemērotākas pretsāpju terapijas izvēlei atsevišķos gadījumos var pieaicināt algologu, sāpju speciālistu. Ja zināms sāpju avots, piemēram, kaulu metastāzes, vai arī plaušu audzējs ieaug krūškurvja sienā, tad sāpju atvieglošanai var izmantot staru terapiju.
Līdzīgi kā citotoksiskās ķīmijterapijas medikamenti, arī mērķterapija var izraisīt blaknes – sliktu dūšu, vēdera izejas traucējumus, ādas un nagu izmaiņas, izmaiņas asins analīzēs. Atkarībā no izteiktības un ietekmes uz pacienta dzīves kvalitāti blaknes iedala smaguma pakāpēs. Blaknes ir ārstējamas un lielai daļai pacientu ārstēšana ar mērķterapiju norit bez izteiktām komplikācijām.
Atkarībā no smaguma pakāpes tiek noteikts, vai ir jāsamazina devas, vai mērķterapija ir jāpārtrauc. Mērķterapijas saņemšanas periodā ik pēc dažiem mēnešiem notiek kontroles vizītes pie ārstējošā onkologa ķīmijterapeita, tiek izvērtētas pacienta sūdzības un asins analīzes. Ja pacientam parādās kādas no blaknēm, par tām ir jāsazinās ar savu ārstējošu ārstu.

Buklets “Dzīve ar plaušu vēzi” - PDF
Imūnterapiju pielieto plaši izplatīta vai metastātiska plaušu vēža ārstēšanai, kad nav iespējama efektīva lokāla terapija. Imūnterapija var tikt pielietota kā vienīgais medikaments, vai kombinācijā ar ķīmijterapiju. Lai novērtētu potenciālo imūnterapijas efektivitāti, veic PD-L1 receptoru noteikšanu plaušu vēža audu paraugā. Imūnterapijas medikamenti tiek ievadīti intravenozi ik 2–6 nedēļas.
Pretēji citotoksiskai ķīmijterapijai imūnterapija stimulē, nevis nomāc organisma imunitāti, tāpēc arī imūnterapijas blakusparādības ir saistītas nevis ar imunitātes novājināšanu, bet ar tās stimulāciju. Imunitātes stimulācija var notikt ne tikai pret vēža šūnām, bet arī pret organisma normālām šūnām. Tas izpaužas kā iekaisums, ko organisms izraisa pats pret sevi: ādas iekaisums (dermatīts), locītavu iekaisums (artrīts), vairogdziedzera iekaisums (tireoidīts), zarnu iekaisums (kolīts), plaušu iekaisums (pneimonīts) u.c. (skat. tabulu) Imūnterapijas blakusparādības, ja parādās, tad visbiežāk pirmo trīs mēnešu laikā no terapijas sākuma. Blakusparādības iedala smaguma pakāpēs, un visbiežāk novēro viegli- vidēji izteiktas blakusparādības. Tās ir labi ārstējamas ar kortikosteoīdiem – pretiekaisuma medikamentiem tablešu vai injekciju veidā.
Nogurums, nespēks
Vadīšana/ārstēšana: sakārtot dienas un miega režīmu, biežāk pastaigas svaigā gaisā, adekvāts uzturs un šķidruma uzņemšana dienas laikā.
Ādas izsitumi (dermatīts), nieze
Simptomi: sārti izsitumi dažādās ķermeņa daļās ar/bez niezes.
Vadīšana/ārstēšana: antihistamīnie līdzekļi topiski vai tabletēs niezes mazināšanai, kortikosteroīdu ziedes. Smagākas pakāpes ādas izsitumiem tiek nozīmēta kortikosteroīdu terapija. Ja izsitumi ir viegli vai mazinās, imūnterapiju var turpināt. Ir jāsargā āda no bojājumiem, tiešiem saules stariem.
Vairogdziedzera iekaisums (tireoidīts)
Simptomi: vairogdziedzera hiperfunkcijas gadījumā svīšana, sirdsklauves, nervozitāte, bezmiegs, caureja, ātra sirdsdarbība, svara zudums. Vairogdziedzera hipofunkcijas gadījumā –nogurums, svara pieaugums, aizcietējumi, lēnīgums un salīgums.
Vadīšana/ārstēšana: kortikosteroīdi, vairogdziedzera hormonu terapija endokrinologa uzraudzībā. Imūnterapiju pārtrauc līdz vairogdziedzera funkcija tiek stabilizēta.
Zarnu iekaisums (kolīts), caureja
Simptomi: bieža šķidra vēdera izeja ar/bez asiņu piejaukuma, sāpes vēderā, slikta dūša, atūdeņošanās simptomi (pieaugošs nespēks, paātrināta sirdsdarbība, pazemināts asinsspiediens).
Vadīšana/ārstēšana: adekvāta šķidruma un elektrolītu uzņemšana, kortikosteroīdi, kolonoskopijas izmeklējums zarnu iekaisuma precizēšanai gastroenterologa uzraudzībā. Vidēji smaga un smaga zarnu iekaisuma gadījumā imūnterapiju pārtrauc uz laiku vai pilnībā, smaga zarnu iekaisuma ārstēšana notiek slimnīcas stacionārā gastroenterologa uzraudzībā.
Plaušu audu iekaisums (pneimonīts)
Simptomi: no jauna parādījies sauss klepus vai elpas trūkums, kas ar laiku pasliktinās.
Vadīšana/ārstēšana: ar kompjūtertomogrāfijas izmeklējumu apstiprina izmaiņas plaušās, tiek pārtraukta imūnterapija un tiek uzsākta kortikosteroīdu terapija, antibakteriāla terapija. Smaga pneimonīta gadījumā var būt nepieciešama ārstēšana stacionārā, pneimonologa uzraudzībā.
Aknu iekaisums (hepatīts)
Simptomi: Viegls hepatīts var būt bez simptomiem, izmaiņas tikai asins analīzēs (ALAT, ASAT, bilirubīns). Smaga hepatīta gadījumā var būt apetītes zudums, vēdera pūšanās, caureja, ādas nieze, muskuļu sāpes, bet simptomu var arī nebūt.
Vadīšana/ārstēšana: viegla hepatīta gadījumā turpina terapiju, kontrolējot asins analīžu izmaiņas, vidēji smaga un smaga hepatīta gadījumā imūnterapija tiek uz laiku vai pilnībā pārtraukta, ārsts nozīmē kortikosteroīdus iekaisuma mazināšanai.
Hipofīzes iekaisums (hipofizīts)
Ļoti reta imūnterapijas toksicitāte.
Simptomi: viegls hipofizīts var noritēt bez simptomiem, vidēji smaga un smaga hipofizīta gadījumā var parādīties redzes traucējumi, galvassāpes, izteiktas slāpes, palielināts urīna daudzums u.c. no jauna parādījušies simptomi.
Vadīšana/ārstēšana: kortikosteroīdi iekaisuma mazināšanai, aizvietojošā hormonterapija, var būt nepieciešams pārtraukt imūnterapiju. Tiek nozīmēti papildu testi hipofīzes hormonu noteikšanai.
Ir tādas imūnterapijas blakusparādības, kas izpaužas pavisam reti. Muskuļu vājums, roku un kāju jušanas izmaiņas vai tirpšana var būt nervu sistēmas toksicitātes izpausmes. Vadīšanā lieto kortikosteroīdus līdz brīdim, kamēr simptomi mazinās vai pāriet. Reimatoloģiska toksicitāte var izpausties ar sāpēm locītavās (artrīts) vai muskuļos. Sāpēm ārsts var nozīmēt pretiekaisuma un pretsāpju līdzekļus, kā arī kortikosteroīdus. Var būt nepieciešama reimatologa konsultācija un papildu imūnsupresīva terapija. Ja imūnterapijas blakusefekti ir izteikti un traucē dzīves kvalitāti, terapiju pārtrauc.
Plaušu vēža attīstības riska samazināšanai svarīgākais faktors ir smēķēšanas atmešana. Savukārt, plaušu vēža skrīnings dod iespēju slimību atklāt agrīni un tādējādi sasniegt labākus ārstēšanas rezultātus.
Plauši vēža, līdzīgi kā citu onkoloģisku slimību gadījumā, Tu vari sev palīdzēt sekojoši:
Veido savu ēdienkarti sabalansētu – ik dienas savā ēdienkartē iekļauj dārzeņus, augļus un ogas, pilngraudu produktus, pākšaugus, dzer ūdeni. Gatavojot ēdienu, izmanto tvaicēšanu, sautēšanu un vārīšanu. Ierobežo uzņemtā sāls un cukura daudzumu. Vairāk par uztura ieteikumiem skatīt šeit.
Esi fiziski aktīvs vismaz 30 minūtes katru dienu - ej garās pastaigās, peldi, skrien! Sīkāku informāciju meklējiet šeit.
Atmet smēķēšanu!
Pārdomā savus alkohola lietošanas paradumus un, ja nepieciešams, ierobežo alkohola lietošanas biežumu un daudzumu. Ja saproti, ka alkohola lietošanas paradumos ir nepieciešamas izmaiņas, vērsies pēc palīdzības pie narkologa vai sava ģimenes ārsta.
Smēķēšanas atmešana
Tabakas produktu smēķēšana ir galvenais plaušu vēža riska faktors. Vairāk kā 80% plaušu vēža slimnieku ir esoši vai bijušie smēķētāji. Tāpēc ir ļoti svarīgi smēķēšanu neuzsākt vispār vai to pēc iespējas ātrāk atmest. Tabakas dūmos ir identificētas vismaz 50 potenciāli kancerogēnas vielas, kuras skar elpceļus izklājošas šūnas. Dažas no šīm vielām ir radioaktīvas, dažas ir indes.

Smēķēšanas stāžu rēķina paku gados, t.i. cik gadus pacients smēķējis pa 1 paciņai dienā. Smēķēšanas stāžs > 20 paku gadiem ir saistīts ar nozīmīgi paaugstinātu plaušu vēža risku, īpaši pēc 50 gadu vecuma. Smēķējot cigarešu paciņu dienā plaušu vēža risks palielinās līdz pat 30 reizēm salīdzinot ar nesmēķētājiem! Par nekad nesmēķējušu uzskata cilvēku, kurš dzīves laikā izsmēķēja mazāk par 100 cigaretēm. Pasīvā smēķēšana ir tabakas produktu ieelpošana no gaisa blakus smēķētājam. Tas nozīmē, ka pasīvais smēķētājs ieelpo ar tabakas dūmiem arī kancerogēnus, kas paaugstina risku saslimt ar plaušu vēzi līdz pat 30%. Jo ilgāka ir pasīvās smēķēšanas pieredze, jo lielāks ir plaušu vēža attīstības risks. Ļoti svarīgi pasargāt no pasīvās smēķēšanas bērnus! Alternatīva tabakas smēķēšanai ir “tvaikošana”, veipošana, jeb elektroniskās cigaretes. Šis smēķēšanas veids balstās uz to, ka ierīcē tiek uzsildīts šķidrums ar augu izcelsmes glicerīnu, tas rada tvaikus un ar tvaiku elpceļos tiek nogādāts smēķēšanas ierīcē esošais nikotīns. Pagaidām nav datu par šī smēķēšanas veida tiešo saistību ar plaušu vēzi un ilgtermiņa efektiem, taču ir zināms, ka tvaikošana izraisa nopietnu
elpceļu bojājumu – plaušu audu iekaisumu, asiņošanu no elpceļiem. Tas var ietekmēt ilgtermiņā plaušu vēža attīstības risku. Īpaši bīstama veipošana ir pusaudžiem un jauniešiem, jo var padarīt viņus par nikotīna atkarīgiem un novest pie cigarešu smēķēšanas. Turklāt, e-cigarešu dūmos ir atrasti tādi kancerogēni kā acetāldehīds u.c. Smēķēšanas laikā organismā nonāk nikotīns, kura efekti organismā izraisa
stipru psiholoģisku atkarību. Smēķēšanas atmešana var būt saistīta ar tādām izpausmēm kā dusmas, trauksme, koncentrēšanās grūtības, miega traucējumi. Šie simptomi visstiprāk izpaužas 2–4 nedēļas pēc smēķēšanas pārtraukšanas, bet vēlāk pakāpeniski pāriet. Smēķēšanas atmešanai ir pieejami palīglīdzekļi – nikotīna aizstājterapija, psihoemocionālais atbalsts, specifiski medikamenti. Latvijas
iedzīvotājiem ir pieejamas telefona konsultācijas smēķēšanas atmešanai, informāciju par tām var atrast slimību profilakses un kontroles centra mājaslapā (spkc.gov.lv). Par specifiskiem medikamentiem runājiet ar savu ārstējošo ārstu. Smēķēšanas atmešana ir ļoti svarīga gan plaušu vēža novēršanai, gan plaušu vēža ārstēšanas efektam!

Onkoloģisku slimību skrīningu var aprakstīt šādi: noteiktiem kritērijiem atbilstoša iedzīvotāju grupa ar noteiktu laika intervālu veic noteiktu izmeklējumu, ar kuru agrīni un efektīvi var atklāt dzīvi apdraudošu slimību, pirms tā rada pamanāmus simptomus. Agrīna slimības atklāšana ļauj sasniegt labākus ārstēšanas rezultātus, biežāku izārstēšanos, saglabāt slimnieka dzīves kvalitāti un darba spējas, pagarināt dzīvildzi. Latvijas iedzīvotājiem šobrīd no Nacionālā veselības dienesta līdzekļiem tiek organizēts krūts vēža, dzemdes kakla vēža un kolorektālā vēža skrīnings. Krūts vēža agrīnai atklāšanai izmanto mammogrāfijas izmeklējumu, dzemdes kakla vēža skrīningam šūnu paraugu no dzemdes kakla, kolorektāla vēža agrīnai atklāšanai izmanto slēpto asiņu testu fēcēs.
Pēc GLOBOCAN* datiem, 2020. gadā Latvijā plaušu vēzis bija 2. visbiežāk diagnosticētā onkoloģiskā slimība vīriešiem un 4. visbiežāk diagnosticētā onkoloģiskā slimība abu dzimumu pārstāvjiem. Plaušu vēzis sākuma stadijās nerada simptomus, tāpēc slimība visbiežāk tiek atklāta III–IV stadijā, taču tad ir grūti panākt izārstēšanos. Mirstības ziņā plaušu vēzis ieņēmis 1. vietu onkoloģisko slimību vidū. Tas norāda uz plaušu vēža agrīnās diagnostikas svarīgumu. Relatīvi nesen tika publicēti lielu pētījumu rezultāti, kas apstiprina plaušu vēža skrīninga efektivitāti. 2017. gadā Eiropas Medicīnisko onkologu asociācija (ESMO) ir pieņēmusi lēmumu ieviest plaušu vēža skrīninga programmu Eiropas valstīs. Plaušu vēža skrīnings Latvijā un lielākajā daļā Eiropas valstu šobrīd nav organizēts, tas ir tuvākās nākotnes jautājums. Tomēr, ja cilvēkam ir zināms paaugstināts plaušu vēža attīstības risks, tad pēc 55 gadu vecuma sadarbībā ar savu ģimenes ārstu var veikt plaušu kompjūtertomogrāfiju vai zemo devu kompjūtertomogrāfiju ar mērķi izslēgt plaušu veidojumus.
Plaušu vēža skrīnings – kas tas ir?
Onkoloģisku slimību skrīningu var aprakstīt šādi: noteiktiem kritērijiem atbilstoša iedzīvotāju grupa ar noteiktu laika intervālu veic noteiktu izmeklējumu, ar kuru agrīni un efektīvi var atklāt dzīvi apdraudošu slimību, pirms tā rada pamanāmus simptomus. Agrīna slimības atklāšana ļauj sasniegt labākus ārstēšanas rezultātus, biežāku izārstēšanos, saglabāt slimnieka dzīves kvalitāti un darba spējas, pagarināt dzīvildzi. Latvijas iedzīvotājiem šobrīd no Nacionālā veselības dienesta līdzekļiem tiek organizēts krūts vēža, dzemdes kakla vēža un kolorektālā vēža skrīnings. Krūts vēža agrīnai atklāšanai izmanto mammogrāfijas izmeklējumu, dzemdes kakla vēža skrīningam šūnu paraugu no dzemdes kakla, kolorektāla vēža agrīnai atklāšanai izmanto slēpto asiņu testu fēcēs.
Pēc GLOBOCAN* datiem, 2020. gadā Latvijā plaušu vēzis bija 2. visbiežāk diagnosticētā onkoloģiskā slimība vīriešiem un 4. visbiežāk diagnosticētā onkoloģiskā slimība abu dzimumu pārstāvjiem. Plaušu vēzis sākuma stadijās nerada simptomus, tāpēc slimība visbiežāk tiek atklāta III–IV stadijā, taču tad ir grūti panākt izārstēšanos. Mirstības ziņā plaušu vēzis ieņēmis 1. vietu onkoloģisko slimību vidū. Tas norāda uz plaušu vēža agrīnās diagnostikas svarīgumu. Relatīvi nesen tika publicēti lielu pētījumu rezultāti, kas apstiprina plaušu vēža skrīninga efektivitāti. 2017. gadā Eiropas Medicīnisko onkologu asociācija (ESMO) ir pieņēmusi lēmumu ieviest plaušu vēža skrīninga programmu Eiropas valstīs. Plaušu vēža skrīnings Latvijā un lielākajā daļā Eiropas valstu šobrīd nav organizēts, tas ir tuvākās nākotnes jautājums. Tomēr, ja cilvēkam ir zināms paaugstināts plaušu vēža attīstības risks, tad pēc 55 gadu vecuma sadarbībā ar savu ģimenes ārstu var veikt plaušu kompjūtertomogrāfiju vai zemo devu kompjūtertomogrāfiju ar mērķi izslēgt plaušu veidojumus.